
题目列表(包括答案和解析)
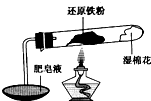 在高温条件下铁与水能发生反应.资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于570℃时,生成Fe0,高于570℃时,生成Fe304.老师用如图所示实验装置,完成还原铁粉与水蒸气反应的演示实验.
在高温条件下铁与水能发生反应.资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于570℃时,生成Fe0,高于570℃时,生成Fe304.老师用如图所示实验装置,完成还原铁粉与水蒸气反应的演示实验.| 实验编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色;有少量气泡产生 |
| ② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液没有出现血红色 |
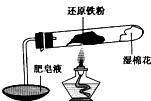 在高温条件下铁与水能发生反应.资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于570℃时,生成FeO,高于570℃时,生成Fe3O4.老师用如图所示实验装置,完成还原铁粉与水蒸气反应的演示实验.
在高温条件下铁与水能发生反应.资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于570℃时,生成FeO,高于570℃时,生成Fe3O4.老师用如图所示实验装置,完成还原铁粉与水蒸气反应的演示实验.
(1)实验中使用肥皂液的作用是______.
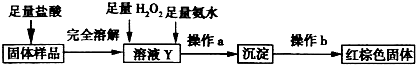
(2)甲同学为探究实验后试管内的固体X中含有哪些物质,进行了下列实验.
| 实验编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色;有少量气泡产生 |
| ② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液没有出现血红色 |
根据上述实验,能确定固体中存在的物质是______;不能确定是否存在Fe0的原因是______.
(3)乙同学设计下列实验方案以确定实验后试管内的固体中是否存在FeO.
确定是否存在Fe0需要测定并记录的实验数据是______.
在T℃条件下,向1L固定体积的密闭容器M中加入2 mol X和1 mol Y,发生如下反应: 2X(g) + Y(g) ![]() a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则:
a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则:
(1)化学计量数a的值为 。
(2)下列说法中能说明该反应达到了化学平衡状态的是 。
A.容器内压强一定 B.容器内气体的密度一定
C.容器内Z分子数一定 D.容器内气体的质量一定
(3)X的转化率α= (用含Q、Q1的代数式表示)。
(4)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是 (稀有气体不参与反应)。
A.2 molX、1mol Y、1molAr
B.a molZ、1mol W
C.1 molX、0.5mol Y、0.5a molZ、0.5 mol W
D.2 molX、1mol Y、1molZ
(5)维持温度不变,若起始时向容器中加入4mol X和6 mol Y,若达平衡时容器内的压强减小了10%,则反应中放出的热量为 kJ。
已知:该反应的平衡常数随温度的变化如下表:
| 温度/℃ | 200 | 250 | 300 | 350 |
| 平衡常数K | 9.94 | 5.2 | 1 | 0.5 |
试回答下列问题
(6)在300℃发生上述反应,以表中的物质的量投入到相同的恒容反应器中,其中向正反应方向转化的有 (选填A.B.C.D.E)。
| n(X) | n(Y) | n(Z) | n(W) | |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 6 |
| D | 0.5 | 2 | 1 | 1 |
| E | 1 | 0.3 | 2 | 2 |
(7)若在某温度下,2 mol X和1 mol Y在该容器中反应达平衡, X的平衡转化率为50%,则该温度为 ℃。
(8)维持T℃条件不变,若在一个和原容器体积相等的恒压容器N 中,加入2 mol X和1 mol Y发生如上反应并达平衡,则 (选填M或N)容器中的反应先达到平衡状态。
在T℃条件下,向1L固定体积的密闭容器M中加入2mol X和1 mol Y,发生如下反应: 2X(g) + Y(g) a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则:
(1)化学计量数a的值为 。
(2)下列说法中能说明该反应达到了化学平衡状态的是 。
A.容器内压强一定 B.容器内气体的密度一定
C.容器内Z分子数一定 D.容器内气体的质量一定
(3)X的转化率α= (用含Q、Q1的代数式表示)。
(4)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是 (稀有气体不参与反应)。
A.2 molX、1mol Y、1molAr
B.a molZ、1mol W
C.1 molX、0.5mol Y、0.5a molZ、0.5 molW
D.2 molX、1mol Y、1molZ
(5)维持温度不变,若起始时向容器中加入4molX和6 mol Y,若达平衡时容器内的压强减小了10%,则反应中放出的热量为 kJ。
已知:该反应的平衡常数随温度的变化如下表:
| 温度/℃ | 200 | 250 | 300 | 350 |
| 平衡常数K | 9.94 | 5.2 | 1 | 0.5 |
试回答下列问题
(6)在300℃发生上述反应,以表中的物质的量投入到相同的恒容反应器中,其中向正反应方向转化的有 (选填A.B.C.D.E)。
|
| n(X) | n(Y) | n(Z) | n(W) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 6 |
| D | 0.5 | 2 | 1 | 1 |
| E | 1 | 0.3 | 2 | 2 |
(7)若在某温度下,2 mol X和1 mol Y在该容器中反应达平衡, X的平衡转化率为50%,则该温度为 ℃。
(8)维持T℃条件不变,若在一个和原容器体积相等的恒压容器N 中,加入2 mol X和1 molY发生如上反应并达平衡,则 (选填M或N)容器中的反应先达到平衡状态。
(9分)一定条件下,在一容积可变的密闭容器中,反应: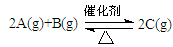 过程中的能量变化如图所示。反应过程中,A、B、C的物质的量(mol)的变化如下表:
过程中的能量变化如图所示。反应过程中,A、B、C的物质的量(mol)的变化如下表: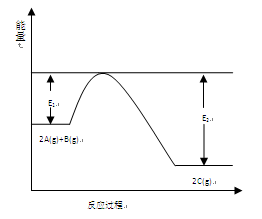
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| n(A) | 2.00 | 1.90 | 1.82 | 1.76 | 1.64 | 1.54 | 1.50 | 1.50 | 1.50 |
| n(B) | 1.00 | 0.95 | 0.91 | 0.88 | 0.82 | 0.77 | 0.75 | 0.75 | 0.75 |
| n(C) | 0 | 0.10 | 0.18 | 0.24 | 0.36 | 0.46 | 0.50 | 0.50 | 0.50 |
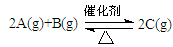 的正反应△H (填“大于”或“小于”)0。
的正反应△H (填“大于”或“小于”)0。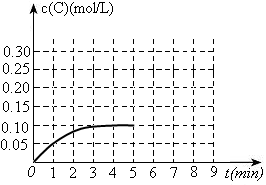
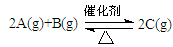 的平衡常数K= 。
的平衡常数K= 。湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com