
题目列表(包括答案和解析)
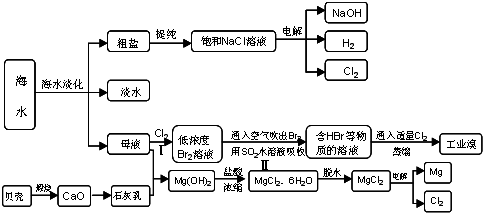
Ⅰ.沿海地区有着丰富的海水资源,海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子。合理利用资源和保护环境是可持续发展的重要保证。
 (1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出电解熔融氯化镁制取金属镁的化学反应方程式???????????????????????????????? 。
(1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出电解熔融氯化镁制取金属镁的化学反应方程式???????????????????????????????? 。
(2)某化工厂生产过程中会产生含有Cu2+和Pb2+的污水。排放前拟用沉淀法除去这两种离子,根据下列数据,你认为投入?????????? (选填“Na2S”或“NaOH”)效果更好。
难溶电解质 | Cu(OH)2 | CuS | Pb(OH)2 | PbS |
Ksp | 4.8×10-20 | 6.3×10-36 | 1.2×10-15 | 1.0×10-28 |
(3)火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题。利用海水脱硫是一种有效的方法,其工艺流程如下图所示:

①天然海水的pH≈8,试用离子方程式解释天然海水呈弱碱性的原因????????? (任写一个)。
②某研究小组为探究提高含硫烟气中SO2吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如图所示。
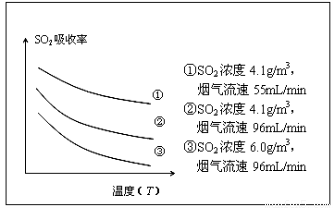
请你根据图示实验结果,就如何提高一定浓度含硫烟气中SO2的吸收效率,提出一条合理化建议:??? 。
③天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,使用氧气将其氧化的化学原理是?????????????????? (任写一个化学方程式或离子方程式)。氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是???????????????????????? 。
Ⅱ.能源是人类生存和发展的重要支柱。研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义。已知下列热化学方程式
①2H2(g)+O2(g)=2H2O(l)????  H=-570kJ/mol;
H=-570kJ/mol;
②H2(g)+1/2O2(g)=H2O(g)???  H=-242kJ/mol;
H=-242kJ/mol;
③C(s)+1/2O2(g)=CO(g)????  H=—110.5kJ/moL;
H=—110.5kJ/moL;
④C(s)+O2(g)=CO2(g)???????  H=—393.5kJ/moL;
H=—393.5kJ/moL;
⑤CO2(g)+2H2O(g)=2CH4(g)+2 O2(g)?  H=+890kJ/moL
H=+890kJ/moL
回答下列问题
(1)上述反应中属于吸热反应的是??????????????? 。
(2)H2的燃烧热为△H=??????????????? 。
(3)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然难直接测定,但可通过间接的方法求得。已知C(s) + H2O(g)=H2(g)+ CO(g)????  H=akJ/moL;则a=???????? ;该反应的熵
H=akJ/moL;则a=???????? ;该反应的熵 S???????? 0(选填“>”、“=”、“<”);已知自由能
S???????? 0(选填“>”、“=”、“<”);已知自由能 G=
G= H—T
H—T S,当
S,当 G<0时可自发进行。则该反应在什么条件下可自发进行__________________。
G<0时可自发进行。则该反应在什么条件下可自发进行__________________。
(4)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是????? 。
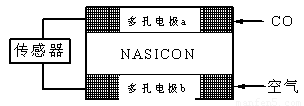
A.负极的电极反应式为:CO+O2—―2e-=CO2
B.工作时电极b作正极,O2—由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高
(15分)
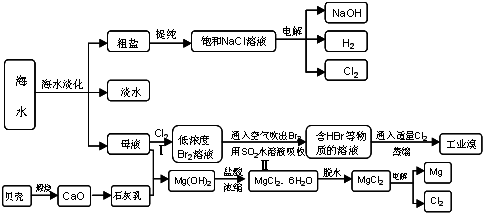
沿海地区有着丰富的海水资源,海水占地球总储水量的97.4﹪,海水是人类宝贵的自然资源,若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海水资源,从海水中可以提取多种化工原料,下图是某工厂对海水资源综合利用的示意图:
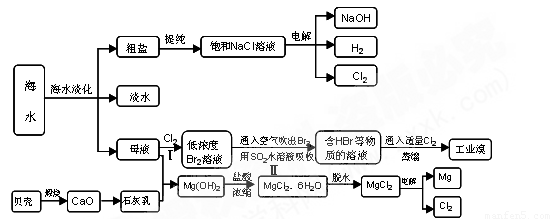
⑴请列举海水淡化的两种方法 、 。
⑵使用离子交换树脂与水中的离子进行交换也是常用的水处理技术。聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式 .
⑶步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br -,其目的是: .
步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式
⑷在制取无水氯化镁时需要在干躁的HCl气流中加热MgCl2.6H2O的原因
.
⑸电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用做镁蒸气的冷却剂的是
A.H2 B.CO2 C.空气 D.O2 E.水蒸气
⑹苦卤(海水蒸发结晶分离出食盐后的母液)中含有较多的NaCl、MgCl2、KCl、MgSO4等物质.用沉淀法测定苦卤中MgCl2的含量(g/L),测定过程中应获取的数据有
.
(12分)盐城作为沿海地区有着丰富的海水资源,海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子。合理利用资源和保护环境是我市可持续发展的重要保证。
![]() (1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出电解熔融氯化镁制取金属镁的化学反应方程式 。
(1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出电解熔融氯化镁制取金属镁的化学反应方程式 。
(2)某化工厂生产过程中会产生含有Cu2+和Pb2+的污水。排放前拟用沉淀法除去这两种离子,根据下列数据,你认为投入 (选填“Na2S”或“NaOH”)效果更好。
| 难溶电解质 | Cu(OH)2 | CuS | Pb(OH)2 | PbS |
| Ksp | 4.8×10-20 | 6.3×10-36 | 1.2×10-15 | 1.0×10-28 |
 |
①天然海水的pH≈8,试用离子方程式解释天然海水呈弱碱性的原因 (任写一个)。
②某研究小组为探究提高含硫烟气中SO2吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如右图所示。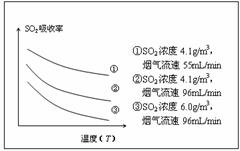
请你根据图示实验结果,就如何提高一定浓度含硫烟气中SO2的吸收效率,提出一条合理化建议: 。
③天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,使用氧气将其氧化的化学原理是 (任写一个化学方程式或离子方程式)。氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是 。
一、二选择题(共63分)
题号
1
2
3
4
5
6
7
8
9
答案
D
B
C
D
D
C
A
A
D
题号
10
11
12
13
14
15
16
17
18
答案
B
AD
B
BC
AB
A
BC
AD
D
19、(共12分) (1)增加反应物接触面积,提高反应速率和原料的利用率(2分)
 SrS+4CO↑(2分) 溶解、过滤(干燥)(2分)。
SrS+4CO↑(2分) 溶解、过滤(干燥)(2分)。
(2)碳酸锶的溶解度小于硫酸锶的溶解度(1分)
水浴(油浴、液体浴)加热、搅拌(各1分,共2分)
(3)方法一(1分)
(4)ABCD(2分,少答一个扣1分)
20、(共10分)(1)(每空1分)
实验编号
T/K
试管内取用液体
实验目的
①
298
食盐水
(Ⅱ)③
(Ⅲ)④(只要与前面③、④对应即可)
②
298
碳酸水
③
308
食盐水
④
298
植物油
(2) AC (2分)
21、(共12分)方案一:(1)取一片pH试纸放在表面皿(或玻璃片)上,用洁净的玻璃棒蘸取待测液滴到试纸上,当试纸颜色变化稳定后立即与标准比色卡对照。(3分)
(2)方案二:(1)赶走溶液中少量氧气,隔绝氧气;不正确(3分) (2)碱,不正确(2分)
(3)
实验方法
观察到的现象
取上述滴有酚酞的NaOH溶液慢慢加水稀释(或取上述NaOH溶液稀释后再加入酚酞溶液) (2分)
出现红色且不褪去 (2分)
22、(共12分) ⑴MgCl2(熔融)  Mg+Cl2↑ ⑵Na2S
Mg+Cl2↑ ⑵Na2S
⑶①CO32-+H2O HCO3-+OH-(或2H2SO4)或 HCO3-+H2O
HCO3-+OH-(或2H2SO4)或 HCO3-+H2O H2CO3 +OH-
H2CO3 +OH-
②降低含硫烟气的温度(或减小含硫烟气的流速)
③2H2SO3+O2=4H++2SO42-或2HSO3-+O2=2H++2SO42-
中和、稀释经氧气氧化后海水中生成的酸(H+),减少污染。(每空2分,共12分)
23、(共10分) ⑴
 ⑵66.7%或66.67% 作图要点:①起点(0,0.75) ②平衡点(8之后,0.25) ③走势逐渐减小(下弧线);(根据等效平衡理论或K计算)
⑵66.7%或66.67% 作图要点:①起点(0,0.75) ②平衡点(8之后,0.25) ③走势逐渐减小(下弧线);(根据等效平衡理论或K计算)
⑶A (因c(CO)/c(CO2)=k,只受温度影响)
⑷②2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O (每空2分,共10分)
24、(共11分) (1)保护臭氧层 (2分)
(2)①2KHCO3  K2CO3+CO2↑+H2O(2分)
K2CO3+CO2↑+H2O(2分)
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g);△H=―49.5kJ/mol (3分)
(3)Ba(OH)2 (或NaOH和BaCl2混合溶液)(2分) ; 生成沉淀的质量(2分)
25、(共10分)(1)取代反应、加成反应 (每空1分,共2分)
(2)
(2分,缺少乙酸不给分)
(3)C (2分)
(4)R―CH(CH3)OH + CO → R―CH(CH3)COOH (R代表左侧苯环部分) (2分);
(5) (2分)
(2分)
26、(共10分)
(1) CH3CHBrCH3 (1分); (2) 取代反应 (1分)
⑶ (2分)
(2分)
⑷ (2分)
(2分)
(5)HOCH2CH2CH2CHO、CH3CH(OH)CH2CHO或CH3CH2CH(OH)CHO
(CH3)2C(OH)CHO、HOCH2CH(CH2)CHO (写其中任意2个)(每空2分,共4分)
27、(共10分)⑴1s22s22p63s23p63d104s1 ⑵ 1:5
⑶①A、C ②平面正方型 ③9; 1 (每空2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com