
题目列表(包括答案和解析)

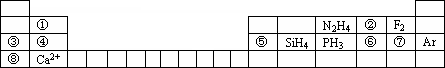
(本题共10分)元素周期表揭示了许多元素的相似性和递变规律,同一周期元素所构成的某些微粒往往具有相同的电子数,周期表中主族元素可以构成许多电子数为10或18的微粒。如下列周期表中所示的一些物质或离子。
|
|
| |||||||||||||||
| ① |
|
|
|
| N2H4 | ② | F2 |
| ||||||||
③ | ④ |
| ⑤ | SiH4 | PH3 | ⑥ | ⑦ | Ar | |||||||||
⑧ | Ca2+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)写出⑥元素的离子的核外电子排布示意图____________________。
(2)比较③④⑤⑥⑦形成的单核离子的半径大小:_____>_____>_____>_____>_____(写离子符号)
(3)①元素与⑤元素的氢氧化物有相似的性质,写出①元素的氢氧化物与足量的NaOH溶液反应的化学方程式___________________________________。
(4)分别写出含有⑥号元素的某种18电子的微粒和含有②号元素的两种10电子的离子间反应的离子方程式:________________________,_________________________。
元素周期表揭示了许多元素的相似性和递变规律。同一周期构成的某些微粒往往具有相同的电子数,如周期表中主族元素可以构成许多电子数为10或18的微粒。下列周期表中列出一些均与对应元素有关的18电子微粒。
(1)①为8核微粒,其名称为_________;②的电子式____________。
(2)④⑤⑥⑦对应元素形成的简单离子半径从小到大的顺序为__________________(用离子符号表示)。
(3)写出⑤对应元素与水反应的离子方程式___________________。
(4)④对应的某种18电子的离子与![]() 和
和![]() 均可发生反应,写出其与
均可发生反应,写出其与![]() 反应
反应
的离子方程式:_____________________________
(5)在火箭推进器中装有液态N2H4和液态②,已知0.4mol液态N2H4和足量液态②反应,生成一种气态单质和一种常见液态氢化物,放出256.6kJ的热量,则该反应的热化学方程式为________________________________________。
元素周期表揭示了许多元素的相似性和递变规律。同一周期构成的某些微粒往往具有相同的电子数,如周期表中主族元素可以构成许多电子数为10或18的微粒。下列周期表中列出一些均与对应元素有关的18电子微粒。
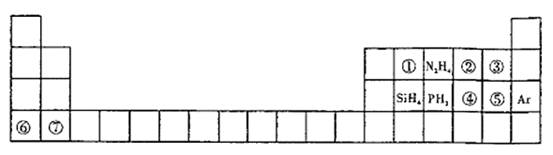
(1)①为8核微粒,其名称为_________;②的电子式____________。
(2)④⑤⑥⑦对应元素形成的简单离子半径从小到大的顺序为__________________(用离子符号表示)。
(3)写出⑤对应元素与水反应的离子方程式___________________。
(4)④对应的某种18电子的离子与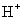 和
和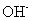 均可发生反应,写出其与
均可发生反应,写出其与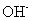 反应
反应
的离子方程式:_____________________________
(5)在火箭推进器中装有液态N2H4和液态②,已知0.4mol液态N2H4和足量液态②反应,生成一种气态单质和一种常见液态氢化物,放出256.6kJ的热量,则该反应的热化学方程式为________________________________________。
元素周期表揭示了许多元素的相似性和递变规律,同一周期元素所构成的某些微粒往往具有相同的电子数,周期表中主族元素可以构成许多电子数为10或18的微粒.如下列周期表中所示的一些物质或离子.
(1)写出⑥元素的离子的核外电子排布示意图________.
(2)比较③④⑤⑥⑦形成的单核离子的半径大小:________>________>________>________>________(写离子符号)
(3)①元素与⑤元素的氢氧化物有相似的性质,写出①元素的氢氧化物与足量的NaOH溶液反应的化学方程式________.
(4)分别写出含有⑥号元素的某种18电子的微粒和含有②号元素的两种10电子的离子间反应的离子方程式:________,________.
一、选择题(本题包括20小题,1―10题每题2分,11―20题每题3分,共50分。每小题只有一个选项符合题意)
1―5 DCBBA 6―10 CBCCB 11―15 BDCAD 16―20 DAADA
二、(本题包括3小题,共21分)
21.(6分)
(1)KOH(1分)
(2)Ar K+(Ca2+、HS-、S2-、 ) F2 HCl(N2H4、SiH4、PH3、H2S、H2O2、CH3OH) 【错的倒扣分,多写的同类重复的不倒扣分】(4分)
) F2 HCl(N2H4、SiH4、PH3、H2S、H2O2、CH3OH) 【错的倒扣分,多写的同类重复的不倒扣分】(4分)
(3) (1分)
(1分)
22.(10分)
(1)FeCl2 KSCN(或NH4SCN)溶液(2分)
(2)d(2分)
(3) (2分)
(2分)
(4)溶液中的Fe2+被氧化剂氧化成Fe3+,使Fe3+增多从而使红色加深(1分)
(5)假设:加入还原剂将Fe3+还原(1分)
用胶头滴管取少量黄色褪色后的溶液于试管中,滴加少量KSCN溶液,再加入几滴氯水,如果溶液开始不出现红色,加氯水后出现红色,则说明假设正确,若溶液不变红色,则假设不正确。(2分)(有其他合理假设、答案也可酌情得分)。
23.(5分)
(1) (1分)
(1分)
(2)CH3CHO(1分)
(3)HCOOH(1分)
(4)DE(2分)
三、(本题包括2小题,共15分)
24.(10分)
(1)B、E、F、I(4分,多选、漏选、错选一个扣1分,扣完为止)
(2)D(1分)制氯气的D中进气导管应深入集气瓶底,(1分)逸出的氯气应通入盛有烧碱溶液的烧杯中。(1分)
干燥氨气;(1分)
 (2分)
(2分)
25.(5分)
(1) (1分)
(1分)
(2)甲 现象:气球膨胀
原因:二氧化碳和氢氧化钠溶液反应,使锥形瓶内气体压强减小,大气压使气球胀大。(2分)
乙 现象:烧杯内的水流入锥形瓶中
原因:二氧化碳和氢氧化钠溶液反应,使锥形瓶内气体压强减小,大气压将水压入锥形瓶中。(2分)
四、(本题包括2小题,共14分)
26.(8分)
(1)甲基丙烯或2―甲基丙烯  (2分,各1分)
(2分,各1分)
(2)②取代反应(或水解反应) ④消去反应(2分,各1分)
(3)(2分)

(4) (2分,其他合理写法都给分)
(2分,其他合理写法都给分)
27.(6分)
(1)8.0 mol/L(2分)(注意有效数字)
(2) (或
(或 )(2分)
)(2分)
画图(2分)

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com