
题目列表(包括答案和解析)
室温时,下列液体的密度比纯水密度大的是( )
A.硝基苯 B.浓氨水 C.乙醇 D.汽油
乙酰苯胺作为一种常用药,具有解热镇痛的效果.实验室制备乙酰苯胺时,可以用苯胺与乙酸酐或与冰醋酸加热来制取,苯胺与乙酸酐的反应速率远大于与冰醋酸反应的速率,已知苯胺微溶于冷水;纯乙酰苯胺是无色片状晶体,熔点114℃,不溶于冷水,可溶于热水;乙酸酐遇水缓慢反应生成乙酸;现选用苯胺与乙酸酐为原料制取和提纯乙酰苯胺,该放热反应的原理:
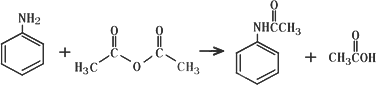
实验步骤:
①取5.0 mL苯胺(密度1.04 g/mL),倒入100 mL锥形瓶中,加入20 mL水,在旋摇下分批加入6.0 mL乙酸酐(密度1.08 g/mL),搅拌均匀.若有结块现象产生,用玻璃棒将块状物研碎,再充分搅拌;
②反应完全后,及时把反应混合物转移到烧杯中,冷却后,抽滤,洗涤,得粗乙酰苯胺固体;
③将粗产品转移至150 mL烧杯中,加入适量水配制成80℃的饱和溶液,再加入过量20%的水.稍冷后,加半匙活性炭,搅拌下将溶液煮沸3~5 min,过滤Ⅰ,用少量沸水淋洗烧杯和漏斗中的固体,合并滤液,冷却结晶,过滤Ⅱ、洗涤、晾干得乙酰苯胺纯品.
(1)步骤①研碎块状产物的用意在于________;反应温度过高会导致苯胺挥发,下列可以控制反应温度,防止反应温度升高过快的操作有________.
A、反应快结束时的充分搅拌
B、旋摇下分批加入6.0 mL乙酸酐
C、玻璃棒将块状物研碎
D、加20 ml水
(2)步骤②洗涤粗产品时,选用的溶剂是________.
A、热水
B、冷水
C、1∶3乙醇溶液
D、滤液
(3)步骤③两次用到过滤,其中过滤Ⅰ选择________(填“过滤”、“趁热过滤”或“抽滤”);配制热溶液时,加入过量溶剂的作用是________(选出正确选项);;
A、防止后续过程中,溶剂损失可能产生的产物析出
B、防止后续过程中,温度降低可能产生的产物析出
C、除去活性炭未吸附完全的有色杂质
(4)步骤③冷却滤液时选择在室温下自然冷却,若选择在冰水浴中冷却会使得到的沉淀颗粒太小,则进行抽滤操作时会________;
(5)步骤③中以下哪些操作不能提高产率________.
①配制成饱和溶液后,加入过量20%的溶剂;
②趁热过滤近沸溶液;
③过滤Ⅰ时用少量沸水淋洗烧杯和漏斗中的固体,合并滤液;
④加活性炭吸附
⑤过滤Ⅱ时的洗涤选用热水代替冷水洗涤固体
A、①④⑤
B、①④
C、④⑤
D、②④⑤
(6)步骤③最后测得纯乙酰苯胺固体6.75 g,已知苯胺、乙酸酐和乙酰苯胺的摩尔质量分别为93 g/mol、102 g/mol、135 g/mol.该实验的产率为________(保留两位有效数字)
某研究小组在实验室探究氨基甲酸胺(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
(1)将一定量纯净的氨基甲酸胺固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
NH2COONH4(s)![]() 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
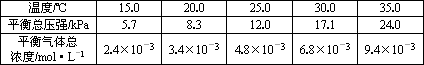
①可以判断该分解反应已经达到平衡的是________.
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数:________
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡.若在恒温下压缩容器体积、氨基甲酸固体的质量________(填“增加”、“减少”、或“不变”)
④氨基甲酸铵分解反应的焓变△H________0(填“>”“=”或“<”=)焓变△S________0(填“>”“=”或“<”=)
(2)
已知:NH2COONH4+2H2O该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率得到c(NH2COO-1)随时间的变化趋势如图所示.
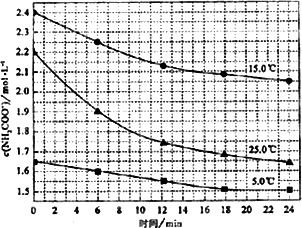
⑤计算25.0℃时,0-6 min氨基甲酸铵水解反应的平均率:________.
⑥根据图中信息,如何说明该水解反应速率随温度升高而增大:________.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
(1)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于下表:

①可以判断该分解反应已经达到化学平衡的是________(填字母).
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,计算25.0℃时的分解平衡常数为________.
(2)已知:NH2COONH4+2H2O![]() NH4HCO3+NH3·H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示.
NH4HCO3+NH3·H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示.

③计算25℃时,0~6 min氨基甲酸铵水解反应的平均速率为________.
④根据图中信息,如何说明水解反应的平均速率随温度升高而增大:________.
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com