
题目列表(包括答案和解析)
(16分)某课外活动小组利用下图装置探究SO2与Na2O2的反应。
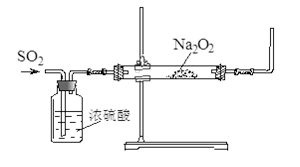
(1)请指出该装置中一个不合理的地方: 。
(2)第1小组同学认为Na2O2与SO2反应类似CO2与Na2O2的反应,该反应的化学方程式为 。
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。他们作出这个推断的理由是 。
(4)第3小组在通入过量SO2后,请你完成对反应完毕后硬质玻璃管中的固体成分的探究。
限选用的试剂:蒸馏水、稀盐酸、稀硫酸、稀硝酸、浓盐酸、浓硫酸、浓硝酸、Ba(NO3)2溶液、BaCl2溶液、1moL·L-1NaOH、0.01mol·L-1KMnO4、紫色石蕊试液。
①提出对玻璃管中固体成分的合理假设:
假设Ⅰ:全部为Na2SO3;
假设Ⅱ:为Na2SO3和Na2SO4的混合物;
假设Ⅲ: ;
②设计实验方案(不要在答题卡上作答)。
③实验过程
根据②的实验方案,请在答题卡上写出实验步骤以及预期现象和结论。
| 实验步骤 | 预期现象和结论 |
| 步骤1:用药匙取少量固体于试管中,加入适量蒸馏水充分溶解后,将所得溶液分置于A、B试管中。 |
|
| 步骤2: |
|
| 步骤3: |
|
某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(1)请完成SO2与过量NaOH溶液反应的化学方程式: ________________.
(2)反应Cl2+Na2SO3+2 NaOH===2NaCl+Na2SO4+H2O中的还原剂为_________.
(3)请完成MnO2和浓盐酸制备Cl2的离子方程式: _______ _________.
(4)如果14.2g氯气与足量的氢气反应,然后生成的气体用500mL某浓度的NaOH溶液恰好反应,则此NaOH的浓度为 (请写出计算过程)
(5)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl![]() 、OH
、OH![]() 和SO
和SO![]() .请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
①提出合理假设 .
假设1:只存在SO32-;假设2:既不存在SO32-也不存在ClO![]() ;假设3:SO32-、ClO
;假设3:SO32-、ClO![]() 都存在。
都存在。
设计实验方案,进行实验。请在答题卡上写出与实验步骤相应的预期现象和结论。限选实验试剂:3moL![]() L-1H2SO4、1moL
L-1H2SO4、1moL![]() L-1NaOH、0.01mol
L-1NaOH、0.01mol![]() L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
| 实验步骤 | 预期现象和结论 |
|
| |
| 步骤2:在A试管中滴加紫色石蕊试液 | |
| 步骤3:在B试管中滴加0.01mol |
(16分)某混合金属粉末,铝处还含有铁、铜中的一种或两种,所含金属的量都在5%以上。请设计合理实验探究该混合物金属粉末中铁、铜元素的存在。仅限选择的仪器和试剂:烧杯、试管、玻璃棒、量筒、容量瓶、滴管、药匙;1mol/L硫酸、2 mol/L硝酸、2mol/LNaOH溶液、20%KSCN溶液。完成以下实验探究过程:
mol/L硝酸、2mol/LNaOH溶液、20%KSCN溶液。完成以下实验探究过程:
[提出假设] 假设1 该混合金属粉末中除铝外还含有 元素;
假设2 该混合金属粉末中除铝外还含有 元素;
假设3 该混合金属粉末中除铝外还含有Fe、Cu元素;
[设计实验方案]基于假设3,设计出实验方案(不要在答题卡上作答)。
[实验过程]根据上述实验方案,完成实验的相关操 作、预期现象和结论。
作、预期现象和结论。
| 编号 | 实验操作 | 实验现象 | 结论 |
| ① | 用药匙取少许样品,加入试管A中,再用滴管取过量  ____ 溶液并滴加到试管A中,充分反应 ____ 溶液并滴加到试管A中,充分反应 | 有固体剩余,并有气泡产生 | 合金中除铝外还含有Fe、Cu 元素 |
| ② | 往试管A的剩余固体中加过量 ________ ,充分反应后,静置,取上层清液于试管B中 | 固体部分溶解,并有气体放出,溶液呈浅绿色 | |
| ③ | 往试管B中加入少量 _____,再滴加KSCN溶液 | _____ | |
| ④ | 往②剩余固体中加入稀硝酸;再滴加 ____________ 溶液. | 固体溶解,有无色刺激性气体产生并很快变成红棕色,溶液显蓝色;再加某溶液后有蓝色沉淀产生 |
(16分)某课外活动小组利用下图装置探究SO2与Na2O2的反应。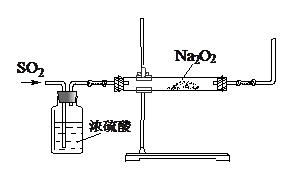
(1)请指出该装置中一个不合理的地方: 。
(2)第1小组同学认为Na2O2与SO2反应类似CO2与Na2O2的反应,该反应的化学方程式为 。
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。他们作出这个推断的理由是 。
(4)第3小组在通入过量SO2后,请你完成对反应完毕后硬质玻璃管中的固体成分的探究。
限选用的试剂:蒸馏水、稀盐酸、稀硫酸、稀硝酸、浓盐酸、浓硫酸、浓硝酸、Ba(NO3)2溶液、BaCl2溶液、1moL·L-1NaOH、0.01mol·L-1KMnO4、紫色石蕊试液。
①提出对玻璃管中固体成分的合理假设:
假设Ⅰ:全部为Na2SO3;
假设Ⅱ:为Na2SO3和Na2SO4的混合物;
假设Ⅲ: ;
②设计实验方案(不要在答题卡上作答)。
③实验过程
根据②的实验方案,请在答题卡上写出实验步骤以及预期现象和结论。
| 实验步骤 | 预期现象和结论 |
| 步骤1:用药匙取少量固体于试管中,加入适量蒸馏水充分溶解后,将所得溶液分置于A、B试管中。 | |
| 步骤2: | |
| 步骤3: | |
(12分)三草酸合铁酸钾晶体K3 [Fe(C2O4 )3]?3H2O可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
限选试剂:浓硫酸、1.0 mol?L-1HNO3、1.0 mol?L-1盐酸、1.0 mol?L-1 NaOH、3% H2O2 、0.1mol?L-1KI、0.1 mol?L-1CuSO4、20% KSCN、澄清石灰水、氧化铜、蒸馏水。
(1)将气体产物依次通过澄清石灰水(A)、浓硫酸、灼热氧化铜(B)、澄清石灰水(C),观察到A、C中澄清石灰水都变浑浊,B中有红色固体生成,则气体产物是 。
(2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。验证固体产物中钾元素存在的方法是 ,现象是 。
(3)固体产物中铁元素存在形式的探究。
①提出合理假设
假设1: ; 假设2: ;假设3: 。
②设计实验方案证明你的假设(不要在答题卡上作答)
③实验过程
根据②中方案进行实验。在答题卡上按下表的格式写出实验步骤、预期现象与结论。
实验步骤 | 预期现象与结论 |
步骤1: | |
步骤2: | |
步骤3: | |
…… |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com