现有一瓶浓度为0.2mol/L的某酸溶液,可能为醋酸、盐酸、硫酸中的一种.
为了确定该酸溶液的组成进行实验:取25.00mL0.1mol/L的氢氧化钠溶液,逐滴加入该酸溶液,恰好反应完全时所需该酸溶液体积为12.50mL.请回答:
(1)该酸不可能是
硫酸
硫酸
;
(2)用pH试纸测得反应后所得溶液呈碱性,根据此现象说明该酸溶液为
醋酸
醋酸
,用离子方程式说明溶液呈碱性的原因
CH3COO-+H2O?CH3COOH+OH-
CH3COO-+H2O?CH3COOH+OH-
;
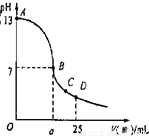
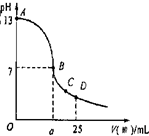
(3)实验中滴定曲线如图,在B点,a
大于
大于
12.5(填大于、小于或等于)
在C点各离子浓度由大到小排序
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
.

 现有一瓶浓度为0.2mol/L的某酸溶液,可能为醋酸、盐酸、硫酸中的一种.
现有一瓶浓度为0.2mol/L的某酸溶液,可能为醋酸、盐酸、硫酸中的一种.