
题目列表(包括答案和解析)
| T/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| 时间/min | CO2 | H2 | CO | H2O |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| (0.100)2 |
| 0.100×0.200 |
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| (0.100)2 |
| 0.100×0.200 |
在一固定容积的密闭容器中,进行如下反应:
C(s)+H2O(g) CO(g)+H2(g)
CO(g)+H2(g)
27.反应后物质的总能量增大,则该反应为________反应(填“吸热”或“放热”)。
28.不能判断该反应是否达到化学平衡状态的是________(选填编号)。
a.容器中气体压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(H2O)=c(CO)
29.若容器容积为2L,反应10s后测得混合气体的总质量增加了2.4g, 则CO的平均反应速率为 mol/(L?S);若再增加固态碳的量,则正反应的速率 (选填“增大”、“减小”、“不变”)。
在一固定容积的密闭容器中,进行如下反应:
C(s)+H2O(g) CO(g)+H2(g)
CO(g)+H2(g)
27.反应后物质的总能量增大,则该反应为________反应(填“吸热”或“放热”)。
28.不能判断该反应是否达到化学平衡状态的是________(选填编号)。
a.容器中气体压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(H2O)=c(CO)
29.若容器容积为2L,反应10s后测得混合气体的总质量增加了2.4g, 则CO的平均反应速率为 mol/(L?S);若再增加固态碳的量,则正反应的速率 (选填“增大”、“减小”、“不变”)。
 CO(g)+H2(g)
CO(g)+H2(g)  CO(g)+ H2O(g) △H =" Q" kJ·mol—1
CO(g)+ H2O(g) △H =" Q" kJ·mol—1| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
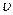 正(H2)=
正(H2)=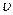 逆(CO) (d) CO2的质量分数不变
逆(CO) (d) CO2的质量分数不变 CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内各物质的浓度变化如下表:
CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内各物质的浓度变化如下表:| 时间(min ) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 | |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com