利用N
2和H
2可以实现NH
3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
(1)已知:N
2(g)+O
2(g)═2NO(g)△H=+180.5kJ/mol
N
2(g)+3H
2(g)═2NH
3(g)△H=-92.4kJ/mol
2H
2(g)+O
2(g)═2H
2O(g)△H=-483.6kJ/mol
若有17g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为
226.3kJ
226.3kJ
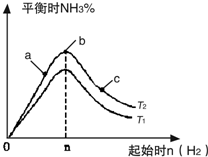
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N
2(g)+3H
2(g)═2NH
3(g)反应的影响.
实验结果如图所示:(图中T表示温度,n表示物质的量)
①图象中T
2和T
1的关系是:T
2低于
低于
T
1(填“高于”、“低于”、“等于”或“无法确定”).
②比较在a、b、c三点所处的平衡状态中,反应物N
2的转化率最高的是
c
c
(填字母).
③在起始体系中加入N
2的物质的量为
mol时,反应后氨的百分含量最大;若容器容积为1L,n=3mol反应达到平衡时H
2的转化率为60%,则此条件下(T
2),反应的平衡常数K=
2.08
2.08
.
④若该反应在298K、398K时的平衡常数分别为K
1,K
2,则K
1>
>
K
2(填“>”“=”“<”)
⑤对于该反应有关表述正确的是
bd
bd
.
a.其他条件不变,缩小容器体积时正反应速率增大,逆反应速率减小,故平衡将逆向移动
b.绝热条件下,若测得该体系温度不再改变,则反应处于平衡状态
c.恒容条件下,若容器内气体的密度保持不变,则反应处于平衡状态
d.其他条件不变,将容器体积扩大为原来的2倍,则重新平衡时,NH
3的平衡浓度将比原平衡浓度的一半还要小.

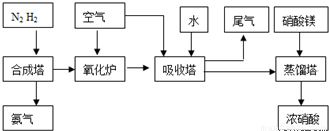
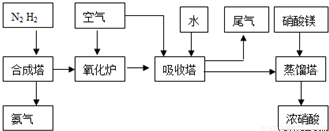
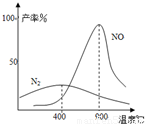
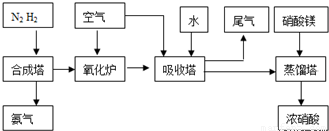
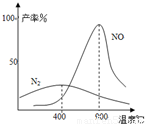
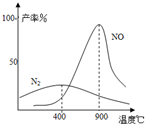 (2009?中山模拟)工业合成氨与制备硝酸一般可连续生产,流程如下:
(2009?中山模拟)工业合成氨与制备硝酸一般可连续生产,流程如下: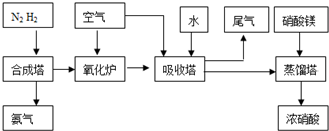
 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题: