
题目列表(包括答案和解析)
| |||||||||||||||
(1)现代健康中掀起一股“绿色食品”热风,海草越来越受到大家的青睐,是因为它含有丰富的________________________________。
(2)当把KI溶液加入KMnO4酸性溶液中时,现象是________________,离子方程式是_______________________。
(3)市场上出售含碘盐的包装袋上明确写明“煮好菜后下盐保持碘效”及“防潮、防热、避光”贮存。若含碘盐中加的是碘酸钾或碘化钾(或钠盐),请根据碘元素同族元素有关性质,完成下列问题:
①请用化学方程式对包装的注意事项加以解释。
②请用一种试纸,方便准确地测试某食盐是否为碘盐,并写出检验的操作及反应的离子方程式。
现代生活中,人们越来越注意微量元素的摄入.碘元素对人体健康有着至关重要的作用.为了预防碘缺乏病,我国卫生部规定每千克食盐中应含有40-50mg碘酸钾.
回答下列问题:
(1)加碘食盐的包装袋上通常标有如下食用建议:勿长时间炖炒.请简述其中所包含的化学原理________.
(2)![]() 可用电解方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定温度和电流强度下电解KI溶液.总反应方程式为:_____________________________________
可用电解方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定温度和电流强度下电解KI溶液.总反应方程式为:_____________________________________
![]() ,则两极的电极反应式分别为:阴极________;阳极________.
,则两极的电极反应式分别为:阴极________;阳极________.
(3)为检验某食盐中是否含有碘酸钾,某同学取食盐样品428g完全溶解于水中,然后加入盐酸酸化的淀粉碘化钾溶液,结果溶液呈蓝色,则反应的离子方程式为________.为进一步确定该样品是否为合格产品,该生又用0.030 mol/L的硫代硫酸钠溶液滴定,当用去18.00mL时蓝色刚好褪去(反应方程式为:![]() ),由此通过计算可判断该加碘食盐为________(填“合格”或“不合格”)产品.
),由此通过计算可判断该加碘食盐为________(填“合格”或“不合格”)产品.
回答下列问题:
(1)加碘食盐的包装袋上通常标有如下食用建议:勿长时间炖炒.请简述其中所包含的化学原理________.
(2)![]() 可用电解方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定温度和电流强度下电解KI溶液.总反应方程式为:_____________________________________
可用电解方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定温度和电流强度下电解KI溶液.总反应方程式为:_____________________________________
![]() ,则两极的电极反应式分别为:阴极________;阳极________.
,则两极的电极反应式分别为:阴极________;阳极________.
(3)为检验某食盐中是否含有碘酸钾,某同学取食盐样品428g完全溶解于水中,然后加入盐酸酸化的淀粉碘化钾溶液,结果溶液呈蓝色,则反应的离子方程式为________.为进一步确定该样品是否为合格产品,该生又用0.030 mol/L的硫代硫酸钠溶液滴定,当用去18.00mL时蓝色刚好褪去(反应方程式为:![]() ),由此通过计算可判断该加碘食盐为________(填“合格”或“不合格”)产品.
),由此通过计算可判断该加碘食盐为________(填“合格”或“不合格”)产品.
现代生活中,人们越来越注意微量元素的摄入.碘元素对人体健康有着至关重要的作用.为了预防碘缺乏病,我国卫生部规定每千克食盐中应含有40-50mg碘酸钾.
回答下列问题:
(1)加碘食盐的包装袋上通常标有如下食用建议:勿长时间炖炒.请简述其中所包含的化学原理________.
(2)KIO3可用电解方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定温度和电流强度下电解KI溶液.总反应方程式为:
KI+3H2O KIO3+3H2↑,则两极的电极反应式分别为:阴极________;阳极________.
KIO3+3H2↑,则两极的电极反应式分别为:阴极________;阳极________.
(3)为检验某食盐中是否含有碘酸钾,某同学取食盐样品428g完全溶解于水中,然后加入盐酸酸化的淀粉碘化钾溶液,结果溶液呈蓝色,则反应的离子方程式为________.为进一步确证该样品是否为合格产品,该生又用0.030mol/L的硫代硫酸钠溶液滴定,当用去18.00mL时蓝色刚好褪去(反应方程式为:I2+2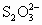 =2I-+
=2I-+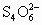 ),由此通过计算可判断该加碘食盐为________(填“合格”或“不合格”)产品.
),由此通过计算可判断该加碘食盐为________(填“合格”或“不合格”)产品.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com