在537℃时,往容积可变的密闭容器中充入2molSO
2(g)、1molO
2(g),此时容器的体积为200L,压强为1.01×10
5Pa。向容器中加入固体催化剂,并保持恒温恒压,发生反应:2SO
2(g)+O
2(g)
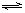
2SO
3(g),达到平衡时,SO
3的体积分数为0.91。
(1)从理论上看,增大压强,平衡向正反应方向移动,SO
2的转化率增大。但工业上二氧化硫催化氧化采用常压而不用高压,主要的原因是_____________。
(2)保持上述温度和压强不变,若向容器中只充入2molSO
3,并加入固体催化剂,则平衡时SO2的体积分数是_______,平衡时混合气体的体积是__________。
(3)温度仍保持537℃,容器的体积保持200L不变。充入amolSO2和bmolO
2,并加入固体催化剂,反应达到平衡时,SO
3的体积分数仍为0.91,体系压强为1.01×10
5Pa。若a∶b=2∶1,则a=________。

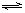 2SO3(g),达到平衡时,SO3的体积分数为0.91。
2SO3(g),达到平衡时,SO3的体积分数为0.91。