
题目列表(包括答案和解析)
常温时将两种溶液等体积混合,其中溶液pH一定或可能等于7的情况共有
①pH=2盐酸和pH=12 NaOH溶液 ②pH=2醋酸和pH=12 NaOH溶液
③pH=2盐酸和pH=12氨水 ④pH=2某酸和pH=12 NaOH溶液
⑤pH=2盐酸和pH=12某碱溶液 ⑥pH=2硫酸和pH=12 NaOH溶液
⑦pH=2盐酸和pH=12 Ba(OH)2溶液 ⑧pH=2硫酸和pH=12 Ba(OH)2溶液
A.5种 B.6种 C.7种 D.8种
 Cu(OH)2+2H+
Cu(OH)2+2H+ Cu(OH)2+2H+
Cu(OH)2+2H+
| ||
| ||
(10分)(1)常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
①写出酸H2A的电离方程式__________________________。
②若溶液M由2 mol·L-1NaHA溶液与2mol·L-1NaOH溶液等体积混合而得,则溶液M的pH ____7 (填“>”、“<”或“=”);溶液M中各微粒的浓度关系正确的是 。
A.c(Na+)>c(A2-)>c(OH-)>c(H+)
B.c(HA-) +c(H2A) +c(H+)=c(OH-)
C.c(A2-)+c(HA-)+c(H2A)=1 mol·L-1
D. c(A2-)+c(HA-)+c(OH-)=c(Na+)+c(H+)
(2)室温时,氢氧化钙的溶度积KSP =4.7×10-6, 室温时将9 mL0.02 mol·L—1的氯化钙溶液与1 mL pH=13的氢氧化钠溶液混合后(溶液体积可直接加和),溶液中___ 沉淀析出(填“有”或“无”)。
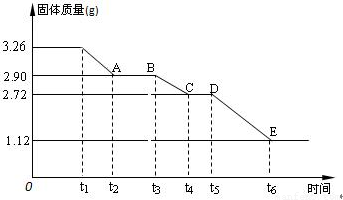
(3) 某校课外活动小组为测定已部分脱水的生石膏的组成(xCaSO4·yH2O),做如下实验:将固体加热,经测量剩余固体质量随时间变化如图所示。
则x:y= 。t2~t3时间段固体的化学式为 。t5~t6时间段固体质量减轻的原因是产生了两种气体,其中一种能使品红溶液褪色。则该时间所发生反应的化学方程式为 。
(10分)(1)常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
①写出酸H2A的电离方程式__________________________。
②若溶液M由2 mol·L-1NaHA溶液与2mol·L-1NaOH溶液等体积混合而得,则溶液M的pH ____7 (填“>”、“<”或“=”);溶液M中各微粒的浓度关系正确的是 。
A.c(Na+)>c(A2-)>c(OH-) >c(H+)
B. c(HA-) +c(H2A) +c(H+)=c(OH-)
C.c(A2-)+c(HA-) +c(H2A)=1 mol·L-1
D. c(A2-)+c(HA-)+c(OH-)=c(Na+)+c(H+)
(2)室温时,氢氧化钙的溶度积KSP =4.7×10-6, 室温时将9 mL0.02 mol·L—1的氯化钙溶液与1 mL pH=13的氢氧化钠溶液混合后(溶液体积可直接加和),溶液中___ 沉淀析出(填“有”或“无”)。
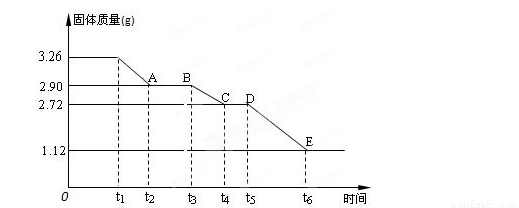
(3) 某校课外活动小组为测定已部分脱水的生石膏的组成(xCaSO4·yH2O),做如下实验:将固体加热,经测量剩余固体质量随时间变化如图所示。
则x:y= 。t2~t3时间段固体的化学式为 。t5~t6时间段固体质量减轻的原因是产生了两种气体,其中一种能使品红溶液褪色。则该时间所发生反应的化学方程式为 。
(10分)(1)常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
①写出酸H2A的电离方程式__________________________。
②若溶液M由2 mol·L-1NaHA溶液与2mol·L-1NaOH溶液等体积混合而得,则溶液M的pH ____7 (填“>”、“<”或“=”);溶液M中各微粒的浓度关系正确的是 。
A.c(Na+)>c(A2-)>c(OH-) >c(H+)
B. c(HA-) +c(H2A) +c(H+)=c(OH-)
C.c(A2-)+c(HA-) +c(H2A)=1 mol·L-1
D. c(A2-)+c(HA-)+c(OH-)=c(Na+)+c(H+)
(2)室温时,氢氧化钙的溶度积KSP =4.7×10-6, 室温时将9 mL0.02 mol·L—1的氯化钙溶液与1 mL pH=13的氢氧化钠溶液混合后(溶液体积可直接加和),溶液中___ 沉淀析出(填“有”或“无”)。
(3) 某校课外活动小组为测定已部分脱水的生石膏的组成(xCaSO4·yH2O),做如下实验:将固体加热,经测量剩余固体质量随时间变化如图所示。
则x:y= 。t2~t3时间段固体的化学式为 。t5~t6时间段固体质量减轻的原因是产生了两种气体,其中一种能使品红溶液褪色。则该时间所发生反应的化学方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com