
题目列表(包括答案和解析)
根据下列叙述回答(1)~(3)题。
在一个容积固定的反应容器有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应:
2A(g)+B(g)=2C(g) | D(g)+3E(g)=2F(g) |
各物质的起始加入量如下:A、B、C、D、E、F的物质的量分别为2mol,1mol,0 mol,Xmol,Ymol,Zmol,两边反应达平衡后,隔板恰好在正中间的位置。
(1)恒温时,若向左边容器中充入0.3mol He(He不与A、B、C、D、E、F反应),下列说法正确的是
A.A的物质的量增加 B.B的转化率增大
C.C的物质的量不变 D.F的浓度,体积分数一定都增大
(2)恒温时,若向左边容器中通人的不是He,而是2 molA和1mol B的气体,则下列说法正确的是
A.A的体积分数不变
B.B的转化率降低
C.C的体积分数、浓度都增大
D.右边容器中气体平均相对分子质量增加
(3)恒温时在(2)题的平衡体系中,若向左右两容器中同时再各注入lmolHe,平衡后与(2)题的平衡体系相比,下列说法正确的是
A.C、F的浓度都不变
B.B的转化率,F的分解率都增加了
C.A、D物质的量都增加了
D.A、B、C、D、E、F物质的量都不变
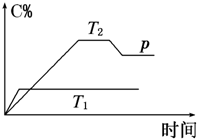

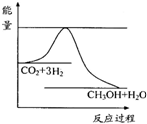 (2009?徐州二模)煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
(2009?徐州二模)煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |

| T/(K) | 298 | 398 | 498 | … |
| K/(mol?L-1)-2 | 4.1×106 | K1 | K2 | … |
2- 4 |
+ 4 |
+ 4 |
2- 4 |
+ 4 |
2- 4 |
+ 4 |
2- 4 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com