
题目列表(包括答案和解析)
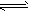 2SO3。平衡后,SO2的转化率为а1,SO2浓度为c1moL/L,SO2体积分数为a1%;若此时再加入2moLSO2与1moLO2,达到新平衡后,SO2的转化率为а2,SO2浓度为c2moL/L,SO2体积分数为
2SO3。平衡后,SO2的转化率为а1,SO2浓度为c1moL/L,SO2体积分数为a1%;若此时再加入2moLSO2与1moLO2,达到新平衡后,SO2的转化率为а2,SO2浓度为c2moL/L,SO2体积分数为在一定温度下,向一固定体积的密闭容器中充入1mol N2和3mol H2,发生反应:N2(g)+3H2(g)![]() 2NH3(g),达到平衡后,又充入1mol N2和3mol H2,下列判断正确的是
2NH3(g),达到平衡后,又充入1mol N2和3mol H2,下列判断正确的是
[ ]
A.刚充入时,体系压强增大,后逐渐减小
B.达到新平衡时,N2和H2的转化率均降低
C.达到新平衡时,NH3的体积分数增大
D.达到新平衡时,c(N2)∶c(H2)∶c(NH3)=1∶3∶2
一定温度下,在一固定容积的密闭容器中发生反应:2NO2(g)  N2O4(g),达平衡时,再向容器内通入一定量的NO2,重新达到平衡后,与第一次平衡相比,NO2的体积分数( )
N2O4(g),达平衡时,再向容器内通入一定量的NO2,重新达到平衡后,与第一次平衡相比,NO2的体积分数( )
A.不变 B.增大
C.减小 D.无法判断
| A、正向反应的速率=逆向反应速率 | B、气体的总质量不再改变时 | C、容器内压强不再发生变化 | D、混合气体的总分子数不再改变 |
(12分)在一定温度下,向一2L固定容积的密闭容器中通入20 molN2和60 molH2,经过5分钟后,N2的浓度是5mol∕L,又过了5分钟 N2 、H2、NH3的浓度不再变化,此时NH3的浓度是14 mol∕L,达到平衡后共放出QKJ的热量,试完成下列问题:
⑴前5分钟用H2表示的化学反应速率( );
⑵反应达到平衡后N2的转化率( );
⑶表示该温度下合成氨的化学平衡常数的表达式为( );
⑷若平衡后再增大压强,化学平衡向( )方向移动(填“正”“逆”“不”);
⑸该温度下反应的热化学方和式为( )(用含Q的式子表示);
⑹在该温度下,向另一2L固定容积的密闭容器中通入N2 5 mol、H215 mol、NH330 mol,反应达到平衡后H2的浓度是( )。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com