
题目列表(包括答案和解析)
[化学—选修物质结构与性质](15分)
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
(1)C、Si、N元素的电负性由大到小的顺序是 。C60和金刚石都是碳的同素异形体,二者比较熔点高的是 ,原因是 。
(2)A、B均为短周期金属元素,依据下表数据,写出B的基态原子的电子排布式 。
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
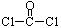 ,每个COCl2分子内含有 个σ键, 个π键。其中心原子采取 杂化轨道方式。
,每个COCl2分子内含有 个σ键, 个π键。其中心原子采取 杂化轨道方式。根据碘与氢气反应的热化学方程式,下列判断正确的是
①I2(g)+H2(g)![]() 2HI(g) ΔH=-9.48 kJ/mol
2HI(g) ΔH=-9.48 kJ/mol
②I2(s)+H2(g)![]() 2HI(g) ΔH=+26.48 kJ/mol
2HI(g) ΔH=+26.48 kJ/mol
(1)写出固态碘生成气态碘的热化学方程式:________.
(2)若反应②吸收52.96kJ热量时,转移电子的物质的量是________mol.
(3)对于在恒温、恒容密闭容器中进行的反应①,能说明其达到化学平衡状态的是________.
A.容器中气体压强不变
B.容器中气体密度不变
C.容器中气体颜色的深浅不变
D.有n个H-H键断裂的同时有2n个H-I键断裂
(4)可通过反应2NO+O2=2NO2和NO2+2H++2I-=NO+I2+H2O来制取碘,NO在制碘过程中的作用是________.
(5)硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放.某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,采用以下方案:如下图所示,图中气体流量计B用于准确测量通过的尾气体积.将尾气通入一定体积已知浓度的碘水中测定SO2的含量.当洗气瓶C中溶液的蓝色消失时,立即关闭活塞A.
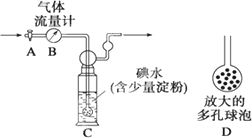
①用碘水测定SO2的含量的化学方程式是________.
②洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是________.
③洗气瓶C中溶液的蓝色消失后,没有及时关闭活塞A,测得的SO2含量________(填“偏高”、“偏低”或“无影响”).
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
(1)C、Si、N元素的电负性由大到小的顺序是___________________,
C60和金刚石都是碳的同素异形体,二者相比,熔点高的是________,原因是____________________________。
(2)A、B均为短周期金属元素,依据表中数据,写出B的基态原子的电子排布式:________________。
| 电离能/(kJ·mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
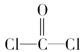 ,每个COCl2分子内含有________个σ键,________个π键,其中心原子采取________杂化轨道方式。
,每个COCl2分子内含有________个σ键,________个π键,其中心原子采取________杂化轨道方式。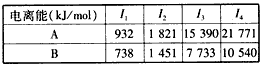
 每个COCl2分子内含有______个σ键,________个π键。其中心原子采取_________ 杂化轨道方式。
每个COCl2分子内含有______个σ键,________个π键。其中心原子采取_________ 杂化轨道方式。湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com