
题目列表(包括答案和解析)
|
已知某温度下的热化学方程式:2SO2(气)+O2(气) | |
| [ ] | |
A. |
Q1<Q2<197 |
B. |
Q1=Q2<197 |
C. |
Q1>Q2>197 |
D. |
Q2<Q1<197 |
已知某温度下的热化学方程式:2SO2(气)+O2(气)![]() 2SO3(气);
2SO3(气);
![]() △H= -197kJ/mol,在同温同压下向密闭容器中通入2 mol SO2和1 molO2,达平衡时放出热量Q1 kJ;向另一相同的密闭容器中通入1.5 mol SO2 、0.75 molO2 和0.5mol SO3达平衡时放出热量Q2 kJ,下列关系正确的是
△H= -197kJ/mol,在同温同压下向密闭容器中通入2 mol SO2和1 molO2,达平衡时放出热量Q1 kJ;向另一相同的密闭容器中通入1.5 mol SO2 、0.75 molO2 和0.5mol SO3达平衡时放出热量Q2 kJ,下列关系正确的是
A.Q1< Q2< 197 B.Ql= Q2< 197
![]() C.Q1> Q2> 197 D.Q2< Q1< 197
C.Q1> Q2> 197 D.Q2< Q1< 197
| 压强/MPa SO2转化率 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
 2SO3(g),△H=-196.6k J/mol,计算每生产1万吨98%硫酸所需要SO3质量为______t,由SO2生产这些SO3时放出的热量为______kJ.
2SO3(g),△H=-196.6k J/mol,计算每生产1万吨98%硫酸所需要SO3质量为______t,由SO2生产这些SO3时放出的热量为______kJ.
| 压强/MPa SO2转化率 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
 2SO3(g),△H=-196.6k J/mol,计算每生产1万吨98%硫酸所需要SO3质量为______t,由SO2生产这些SO3时放出的热量为______kJ.
2SO3(g),△H=-196.6k J/mol,计算每生产1万吨98%硫酸所需要SO3质量为______t,由SO2生产这些SO3时放出的热量为______kJ.
 CaSiO3+CO2
CaSiO3+CO2  2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题 
 2SO3(g)的△H________0(填“>”或“”“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”“向右”或“不移动”)
2SO3(g)的△H________0(填“>”或“”“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡________移动(填“向左”“向右”或“不移动”)  _____
_____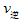 (填“>”“<”或“=”)
(填“>”“<”或“=”)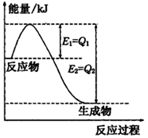

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com