
题目列表(包括答案和解析)
氮元素的单质及其化合物的研究和应用在工农业生产中有着非常重要的地位。工业制硝酸的主要反应之一是
(1)如果将4mol NH3和5mol O2放入容器中,达到平衡时放出热量0.8akJ,则平衡时NH3的转化率为 。
(2)在一定条件下,容积固定的密闭容器中进行上述反应,NO的浓度与时间关系如图所示,则NO的a、b、c三点的反应速率v(a正)、v(b逆)、v(c正)的大小关系是 。

(3)t℃时,在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表:

①第2min到第4mim,反应速率v(O2)= ;
②第2min时改变了条件,改变的条件可能是 (从所给选项中选择);
A.降低温度 B.增加了生成物 C.减小压强 D.使用了高效催化剂
③在与第4min相同的温度下,若起始向容器中加入NH3、O2、NO和H2O(g)的浓度都为2moI/L,则该反应 (填“正反应方向进行”、“逆反应方向进行”、“不移动”)。
(4)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。尿素(H2NCONH2)是一种非常重要的高氮化肥,在温度70—95℃时,工业尾气中的NO、NO2可以用尿素溶液吸收,将其转化为N2,尿素与NO、NO2三者等物质的量反应的化学方程式为 。
(5)目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:

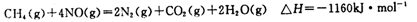
则1mol甲烷直接将NO2还原为N2的烩变为____ 。



| A.降低温度 | B.增加了生成物 | C.减小压强 | D.使用了高效催化剂 |


(1)1.5mol H3PO4的质量是 ,含有 个H3PO4分子;(2)同温、同压下等质量的SO2和NO2,它们所占的体积比为 ,所含氧元素的物质的量之比为______________________;
(3)2 mol O2与1 mol O3的摩尔质量的比是______________。
(4)某化合物的相对分子质量为m,在t ℃ 时A ml该化合物的饱和溶液为B g,将其蒸干后得到固体C g。该化合物在t ℃ 时的溶解度为 g,该饱和溶液中溶质的物质的量浓度为 mol/L。
(2)在标准状况下,某双原子分子的气体单质1.585 g所占体积为500 mL,则该气体的相对分子质量为_________,组成该气体的元素的相对原子质量为_________。
(3)已知CO和CO2的混合气体14.4 g在标准状况下所占体积为8.96 L。则该混合气体中,CO的质量为_________;所含CO2的物质的量为_________。
(19分)已知A、B、C、D、E、F、C、H八种元素位于元素周期表前四个周期。A、B、C是三种非金属元素,A与B的原子的核外电子数之和与C原子的核外电子数相等且A、B、C能形成离子化合物。B与H位于同一主族,D的单质是中学化学常见的两性金属,E的单质是日常生活中用途最广泛的金属且其价电子数是G的两倍,F原子的最外电子层的p电子数是s电子数的两倍,D、H、F位于同一周期且原子序数依次增大,A、C、E、G、H的基态原子中未成对电子数均与其周期序数相同。请用化学用语回答以下问题:
(1)A、B、C形成的此化合物中存在的化学键的类型有 。E单质在常温下遇到A、B、C形成的另一化合物的浓溶液发生钝化现象,过量的E单质在此化合物的稀溶液中发生反应的离子方程式为 ,E的基态电子排布式为 ,E3+与E2+的稳定性大小为 。
(2)B、C、D、H四种元素的第一电离能由大到小的顺序为 ,电负性由小到大的顺序为 。
(3)A、C、G可形成一种相对分子质量为46的一元羧酸分子,其分子中存在的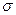 键和
键和 键的数目之比为 ;F、G对应的氢化物中键能大小为F—H键 G—H键。
键的数目之比为 ;F、G对应的氢化物中键能大小为F—H键 G—H键。
(4)等浓度、等体积的盐酸和氢氧化铀溶液分别与足量的D的单质反应放出的气体在常温常压下的体积比为 ,将所得溶液混合刚含有D元素的两种物质间发生反应的离子方程式为 。
(5)由A、C、F可形成两种酸类化合物,用离了方程式说明它们的酸性强弱 。由A、C、F与钠四种元素按原子个数比为l:3:1:1组成一种化合物,其水溶液硅酸性,则该溶液中各种离子的浓度由大到小的顺序为 ,向该溶液中滴入少量的氢氧化钡济液时发生反应的离子方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com