
题目列表(包括答案和解析)

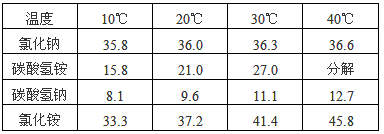
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是________ (填标号)。
A.碳酸氢钠难溶于水?
B.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出?
C.碳酸氢钠受热易分解?
(2)某探究活动小组根据工业制取碳酸钠的原理,进行碳酸氢钠的制备实验, 同学们按各自设计的方案实验。?
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。?
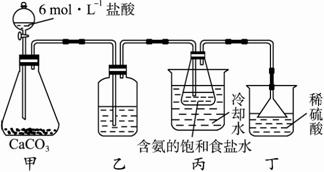
i.乙装置中的试剂是_______________(填标号)。?
A.烧碱溶液?
B.澄清石灰水?
C.浓氨水?
D.蒸馏水?
ii.丁装置的作用是_________________________。?
iii.实验结束后,分离出NaHCO3晶体的操作是_________________(填名称)。
②另一位同学用下图中戊装置(其他装置未画出)进行实验。
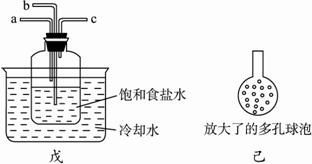
i.实验时,须先从a管通入_________气体,再从b管通入____________气体。?
ii.有同学建议在b管下端连接上图中己装置,理由是__________________________。?
(3)请你再写出一种实验室制取少量碳酸氢钠的方法。____________________________。

| 温度 | 10℃ | 20℃ | 30℃ | 40℃ |
| 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 |
| 碳酸氢铵 | 15.8 | 21.0 | 27.0 | 分解 |
| 碳酸氢钠 | 8.1 | 9.6 | 11.1 | 12.7 |
| 氯化铵 | 33.3 | 37.2 | 41.4 | 45.8 |
| 温度 | 10℃ | 20℃ | 30℃ | 40℃ |
| 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 |
| 碳酸氢铵 | 15.8 | 21.0 | 27.0 | 分解 |
| 碳酸氢钠 | 8.1 | 9.6 | 11.1 | 12.7 |
| 氯化铵 | 33.3 | 37.2 | 41.4 | 45.8 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com