
题目列表(包括答案和解析)
已知298K时下列反应:
Ca(s)+C(s)+![]() O2(g)=CaCO3(s);△H=-1206.8kJ?mol―1 ①
O2(g)=CaCO3(s);△H=-1206.8kJ?mol―1 ①
Ca(s)+![]() O2(g)=CaO(s);△H=-635.1kJ?mol―1 ②
O2(g)=CaO(s);△H=-635.1kJ?mol―1 ②
CaCO3(s)=CaO(s)+CO2(g);△H=+178.2kJ?mol―1 ③
则该温度下12g C完全燃烧的热化学方程式为_____ 。
| T | 298K | 398K | 498K | … |
| K | 4.1×106 | K1 | K2 | … |
(18分)碳、氮、硫是中学化学重要的非金属元素,在工农业生产中有广泛的应用。
(1)用于发射“天宫一号”的长征二号F火箭的燃料是液态偏二甲肼(CH3-NH-NH-CH3),氧化剂是液态四氧化二氮。二者在反应过程中放出大量能量,同时生成无毒、无污染的气体。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,请写出该反应的热化学方程式________________________________________。
(2)298 K时,在2L的密闭容器中,发生可逆反应:2NO2(g) N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时, N2O4的浓度为NO2的2倍,回答下列问题。
N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时, N2O4的浓度为NO2的2倍,回答下列问题。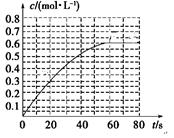
①298k时,该反应的平衡常数为________ L ·mol-1。
②下列事实能判断该反应处于平衡状态的是
a.混合气体的密度保持不变
b.混合气体的颜色不再变化
c. V(N2O4)正=2V(NO2)逆
③若反应在398K进行,某时刻测得n(NO2)="0.6" mol n(N2O4)=1.2mol,则此时
V(正) V(逆)(填“>”“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。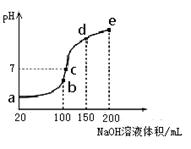
试分析图中a、b、c、d、e五个点,
①水的电离程度最大的是__________;
②其溶液中c(OH-)的数值最接近NH3·H2O的电离常
数K数值的是 ;
③在c点,溶液中各离子浓度由大到小的排列顺序
是__________。
 N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时, N2O4的浓度为NO2的2倍,回答下列问题。
N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时, N2O4的浓度为NO2的2倍,回答下列问题。
| 物质的量/(mol)/时间(h) | 1 | 2 | 3 | 4 | |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com