
题目列表(包括答案和解析)
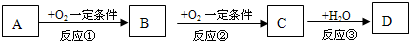
 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如图的反应关系:
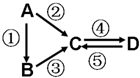
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如图的反应关系: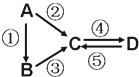 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系: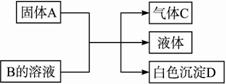
(1)若A为金属钠,B为饱和NaOH溶液,则白色沉淀D为 (写化学式)。?
(2)若A是可溶性强碱,B是正盐,D不溶于稀硝酸,则A与B反应(可加热)的化学方程式为 。?
(3)若A是碳化钙(CaC2),B是一种盐,A与B的溶液反应时只生成气体C、CaCO3和水;则B的化学式为 ;若C的燃烧热为1 300 kJ·mol-1,则C燃烧的热化学方程式为 。?
(4)若B是正盐,D既可溶于盐酸又可溶于NaOH溶液,A的相对分子质量与D相同,向一定量的B溶液中逐渐加入固体粉末A,当A与B以物质的量之比3∶1反应时,生成的D的量最多。推知A的化学式为 ,B的化学式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com