
题目列表(包括答案和解析)
|
下列说法正确的是: | |
| [ ] | |
A. |
HI的相对分子质量大于HF,所以HI的沸点高于HF |
B. |
由ⅠA和ⅥA族元素形成的原子个数比为1∶1、电子总数为38的化合物,是含有共价键的离子型化合物 |
C. |
H与D、16O与18O互为同位素,H2、D2互为同素异形体 |
D. |
在SiO2晶体中,1个Si原子和2个O原子形成2个共价键 |

部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
| 电离平衡常数 (25℃) | 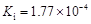 |  | 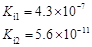 | 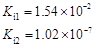 |
 ,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下:
,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下: TeO2+ Te+ I2+ H2O
TeO2+ Te+ I2+ H2O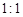 ,试配平上述化学方程式。
,试配平上述化学方程式。| 弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
| 电离平衡常数 (25℃) | 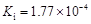 |  |  |  |
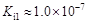 ,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下:
,但它的氧化性比硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下: TeO2+ Te+ I2+ H2O
TeO2+ Te+ I2+ H2O ,试配平上述化学方程式。
,试配平上述化学方程式。湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com