
题目列表(包括答案和解析)
|
在容积固定的密闭容器中,氮气、氢气合成氨的反应达到平衡时,容器中含有0.1 mol N2、0.3 mol H2和0.1 mol NH3.若维持原来的条件,向该容器中再同时加入0.1 mol N2、0.3 mol H2和0.1 mol NH3,则 | |
| [ ] | |
A. |
正、逆反应速率同时增大,平衡不移动 |
B. |
正、逆反应速率同时增大,NH3的浓度增大 |
C. |
正、逆反应速率同时增大,平衡向逆反应方向移动 |
D. |
正、逆反应速率不变,平衡不移动 |
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |

A.正、逆反应速率同时增大,化学平衡不移动
B.正、逆反应速率同时增大,平衡混合气中NH3的体积分数增大
C.正、逆反应速率同时增大,化学平衡向逆反应方向移动
D.正、逆反应速率不变,化学平衡不移动
利用氮气、氢气在一定条件下生成氨气这一可逆反应来合成氨,是一个重要的化工反应。常用来生产液氨和氨水。
完成下列填空:
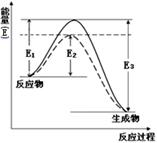
(1)如图表示合成氨时生成1mol生成物时的能量变化,E的单位为kJ。请写出合成氨的热化学方程式____________________。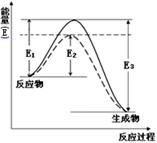
(热量用E1、E2或E3表示)。该图中的实线与虚线部分是什么反应条件发生了变化?
(2)在一定温度下,若将4a mol H2和2amol N2放入VL的密闭容器中,5分钟后测得N2的转化率为50%,则该段时间用H2表示的反应速率为__________摩尔/(升?秒)。若此时再向该容器中投入a mol H2、amol N2和2amol NH3,判断平衡移动的方向是_____(填“正向移动”“逆向移动”或“不移动”)
(3)液氨和水类似,也能电离:2NH3 NH4++ NH2-,某温度时,其离子积K=2×l0-30。该温度下:①将少量NH4Cl固体加入液氨中,K____________2×10-30(填“<”、“>”或“=”);②将少量金属钠投入液氨中,完全反应后所得溶液中各微粒的浓度大小关系为:_______
NH4++ NH2-,某温度时,其离子积K=2×l0-30。该温度下:①将少量NH4Cl固体加入液氨中,K____________2×10-30(填“<”、“>”或“=”);②将少量金属钠投入液氨中,完全反应后所得溶液中各微粒的浓度大小关系为:_______
(4)工厂生产的氨水作肥料时需要稀释。用水稀释0.1mol/L稀氨水时,溶液中随着水量的增加而减少的是
| A.c(NH4+)/c(NH3?H2O) | B.c(NH3?H2O)/c(OH-) |
| C.c(H+)/c(NH4+) | D.c(OH-)/c(H+) |
 NH4++ NH2-,某温度时,其离子积K=2×l0-30。该温度下:①将少量NH4Cl固体加入液氨中,K____________2×10-30(填“<”、“>”或“=”);②将少量金属钠投入液氨中,完全反应后所得溶液中各微粒的浓度大小关系为:_______
NH4++ NH2-,某温度时,其离子积K=2×l0-30。该温度下:①将少量NH4Cl固体加入液氨中,K____________2×10-30(填“<”、“>”或“=”);②将少量金属钠投入液氨中,完全反应后所得溶液中各微粒的浓度大小关系为:_______| A.c(NH4+)/c(NH3?H2O) | B.c(NH3?H2O)/c(OH-) |
| C.c(H+)/c(NH4+) | D.c(OH-)/c(H+) |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com