
题目列表(包括答案和解析)
完成以胆矾为原料制取氧化铜固体实验,并用氧化铜和氯酸钾的混合物制氧气,测量生成氧气的体积。试回答:
(1)向CuSO4溶液中滴加NaOH溶液至不再产生沉淀,反应的离子方程式为
。
(2)将溶液和沉淀放入蒸发皿中加热,直至沉淀全部变黑,冷却后过滤。过滤时由于操作失误,造成滤液浑浊,但滤纸尚未破损。造成滤液浑浊的原因可能是 。
(3)某同学设计了如图所示的装置,用于测量氯酸钾催化作用下分解生成氧气的体积。
①用氧化桶和氯酸钾的混合物制氧气的化学方程式为 。
②检查装置气密性后,将CuO和KClO3的混合物平铺在试管底部,将量筒装满水倒扣在水槽中。后续操作的正确顺序是(用下列操作中的部分或全部步骤代号回答)
。a.用酒精灯给试管中的药品加热
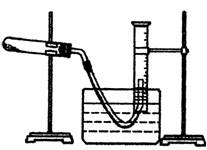 b.待有连续气泡产生时,将导气管出气端管口伸入盛满水的量筒内
b.待有连续气泡产生时,将导气管出气端管口伸入盛满水的量筒内
c.将导气管出气端管口伸入盛满水的量筒内
d.使量筒内液面与水槽中液面持平,然后读数
e.停止加热,使试管冷却至室温(如图,导管出口高于液面)
③按正确操作及顺序完成实验后,测得的气体体积比理论值低,可能的原因是
(4)请设计两种不加热制备氧气的实验方案(用化学方程式表示,反应物不得重复使用)。
| Ⅰ:下列有关实验的描述不正确的是____(填序号); ①用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准溶液润洗,则测定结果偏低。 ② 配制一定物质的量浓度的溶液时,俯视容量瓶的刻度线,会使配制的浓度偏高; ③ 将Fe2(SO4)3溶液加热蒸发至干并灼烧,最后得到红棕色粉末 ④ 硝酸钾过饱和溶液冷却未出现结晶时,可以用玻棒充分磨擦器皿壁促使晶体析出。 ⑤可用25ml酸式滴定管量取20.00mlKMnO4溶液 ⑥分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多 Ⅱ:三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通 过实验来探究红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下: 查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。 提出假设 假设1:红色粉末是Fe2O3 假设2:红色粉末是Cu2O 假设3:红色粉末是Fe2O3和Cu2O的混合物 设计探究实验 取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。 (1)若假设1成立,则实验现象是_________________。 (2)若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?_________________。简述你的理由(不需写出反应的方程式)___________________。 (3)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则证明原固体粉末是____________,写出发生反应的离子方程式________________。 探究延伸 经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。 (4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为________。 (5)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下: | ||||||||||||
| ||||||||||||
| 实验室有下列试剂可供选择: A、氯水 B、H2O2 C、NaOH D、Cu2(OH)2CO3 实验小组设计如下方案 | ||||||||||||
 | ||||||||||||
| 试回答: ①试剂1为_______,试剂2为________(填字母)。 ②固体X的化学式为____________。 ③操作I为___________。 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com