[化学--物质结构与性质]
第4周期过渡金属元素能形成多种多样的配合物.CO可以和过渡金属形成配合物.
(1)Fe
3+离子的电子排布式为
1s22s22p63s23p63d5
1s22s22p63s23p63d5
.配合物Fe(CO)
5的配位体是
CO
CO
.常温下,Fe(CO)
5为黄色液体,易溶于非极性溶剂,熔点为251K,沸点为376K,据此,可判断Fe(CO)
5晶体属于
分子
分子
晶体(填“离子”、“原子”、“分子”或“金属”).CO和N
2的价电子总数相同,CO和N
2相似,分子中都存在一个共价叁键,其中包含
1
1
个δ键,
2
2
个π键.
(2)一般地说,第4周期元素的第一电离能随原子序数的增大而增大,而
31Ga的第一电离能却明显低于
30Zn,原因是
Zn原子的价电子排布式为3d104s2,体系的能量较低,原子较稳定,故Zn的第一电离能大于Ga
Zn原子的价电子排布式为3d104s2,体系的能量较低,原子较稳定,故Zn的第一电离能大于Ga
.
(3)下表为CO和N
2的有关信息.根据表中数据,说明CO比N
2活泼的原因:
CO中第一个π键的键能比N2的第一个π键的键能小很多,CO的第一个π键容易断裂
CO中第一个π键的键能比N2的第一个π键的键能小很多,CO的第一个π键容易断裂
.
| 化学键 |
C-O |
C═O |
C≡O |
| 键能(kJ/mol) |
351 |
803 |
1071 |
| 化学能 |
N-N |
N═N |
N≡N |
| 键能(kj/mol) |
159 |
418 |
945 |
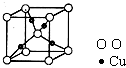
(4)在1个Cu
2O 晶胞中(结构如图所示),所包含的Cu 原子数目为
4
4
.

 [化学--物质结构与性质]
[化学--物质结构与性质]