
题目列表(包括答案和解析)
将不同量的H2O和CO2气体分别通入到一恒容密闭容器中进行反应:
H2O+CO ![]() CO2+H2;得到以下三组数据,据此回答问题
CO2+H2;得到以下三组数据,据此回答问题
实验组 | 温度 | 起始量 | 平衡量 | 达到平衡 所需时间 | ||
H2O | CO | H2 | CO | |||
l | 650℃ | lmol | 2mol | 0.6mol | 1.4mol | 5min |
2 | 900℃ | 0.5mol | 1mol | 0.2mol | 0.8mol | 3min |
3 | 900℃ | a | b | c | d | t |
(1)①由以上数据,实验l中以v (CO2)表示的反应速率为_____________。
②该反应在650℃时平衡常数数值为______,该反应的逆反应为_____(填“吸”或“放”)热反应。
③若实验3要达到与实验2相同的平衡状态,且t<3min,则a,b应满足的关系为:__________。
(2)将0.2mol CO2气体通入到100mL 3mol/L的NaOH溶液中,则所得溶液中各离子浓度关系正确的是____________。
A.c(Na+)>c(HCO3-)>c(OH一)>c(CO32-)>c(H+)
B.c(HCO3-)+c(H2CO3 )+c(CO32-)=2mol/L
C.c(Na+)=2[c(H2CO3)+c(HCO3-)+c(CO32-)]
D.c(Na+)+c(H+)=c(OH一)+2c(CO32-)+c(HCO3-)
(3)已知常温下H2CO3为二元弱酸,其第一、二步电离的电离常数分别为![]() 、Ka2,且
、Ka2,且![]() ≈104Ka2。Na2CO3溶液的第一、二步水解反应的平衡常数称为水解常数,分别为Kh1、Kh2。
≈104Ka2。Na2CO3溶液的第一、二步水解反应的平衡常数称为水解常数,分别为Kh1、Kh2。
①请推导出Kh1与Ka2的关系为_________(用表达式表示);
②常温下,0.01mol/L的Na2CO3溶液的pH为_______(用含Kh1的表达式表示)。
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
(1)将不同量的CO(g)和H2O(g)分别通入体积2L的恒容密闭容器中,进行反应CO(g)+H2O(g)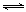 CO2(g)+H2(g),得到如下两组数据:
CO2(g)+H2(g),得到如下两组数据:
|
实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
|
CO |
H2O |
H2 |
CO |
|||
|
1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
|
2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
①实验1中以v(CO2)表示的平均反应速率为 (第二位小数)。
②该反应为 (填“吸热”或“放热”)反应。
③求实验2的平常常数K,要求写出计算过程,结果取二位小数。
(2)已知在常温常压下:
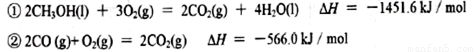
写出甲醇不完全燃烧生成CO和液态水的热化学方程式 。
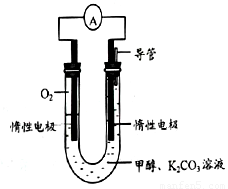
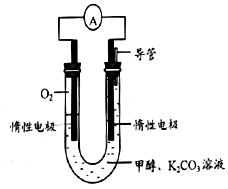
(3)甲醇和氧气完全燃烧的反应可以设计为燃料电池,装置如图,该电池通过K2CO3溶液吸收反应生的CO2。则负极的电极反应为 。
(4)CaCO3的KSP=2.8×10¯9。将等体积CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10¯4mol/L,则生成沉淀所需该CaCl2溶液的最小浓度为 。
(1)将不同量的CO(g)和H2O(g)分别通入体积2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下两组数据:
CO2(g)+H2(g),得到如下两组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com