
题目列表(包括答案和解析)
 某同学为验证Fe能与热的浓HNO3反应,设计了如上图所示的实验装置,a中加入的是Fe片和浓HNO3,b加入的是NaOH溶液.请你参与研究并回答下列问题:
某同学为验证Fe能与热的浓HNO3反应,设计了如上图所示的实验装置,a中加入的是Fe片和浓HNO3,b加入的是NaOH溶液.请你参与研究并回答下列问题: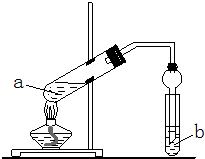
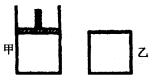
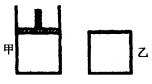
如下图,一定温度下,分别往容积均为5L的甲(恒压容器)、乙(恒容容器)中加入0.5mol无色的![]() 气体,立即出现红棕色。当反应进行到2s时,测得乙容器中
气体,立即出现红棕色。当反应进行到2s时,测得乙容器中![]() 的浓度为0.09mol·
的浓度为0.09mol·![]() 。经过60s,乙容器中的反应达到平衡。(反应过程中两个容器的温度均保持恒定)
。经过60s,乙容器中的反应达到平衡。(反应过程中两个容器的温度均保持恒定)
(1)容器中气体出现红棕色的原因(用化学方程式表示)是:_________________________
_______________________________________________________.
(2)前2s内乙容器中以![]() 的浓度变化表示的反应速率为________.
的浓度变化表示的反应速率为________.
(3)达到平衡时,甲容器中反应所需的时间________60s(填“大于”、“小于”或“等于”,以下同);容器内![]() 的浓度甲________乙;反应过程中吸收的能量甲________乙.
的浓度甲________乙;反应过程中吸收的能量甲________乙.
(4)若要使甲、乙中![]() 浓度相等,不能采取的措施是________(填选项的标号).
浓度相等,不能采取的措施是________(填选项的标号).
A.保持温度不变,适当压缩甲容器体积
B.保持容器体积不变,使甲容器升温
C.保持容器体积和温度不变,向甲容器中加入适量![]()
(1)容器中气体出现红棕色的原因(用化学方程式表示)是:_________________________
_______________________________________________________.
(2)前2s内乙容器中以![]() 的浓度变化表示的反应速率为________.
的浓度变化表示的反应速率为________.
(3)达到平衡时,甲容器中反应所需的时间________60s(填“大于”、“小于”或“等于”,以下同);容器内![]() 的浓度甲________乙;反应过程中吸收的能量甲________乙.
的浓度甲________乙;反应过程中吸收的能量甲________乙.
(4)若要使甲、乙中![]() 浓度相等,不能采取的措施是________(填选项的标号).
浓度相等,不能采取的措施是________(填选项的标号).
A.保持温度不变,适当压缩甲容器体积
B.保持容器体积不变,使甲容器升温
C.保持容器体积和温度不变,向甲容器中加入适量![]()
 如图,一定温度下,分别往容积均为 5L 的甲(恒压容器)、乙(恒容容器)中加入 0.5mol无色的N2O4气体,立即出现红棕色.当反应进行到 2s时,测得乙容器中N2O4的浓度为 0.09mol?L-1.经过 60s,乙容器中的反应达到平衡.(反应过程中两个容器的温度均保持恒定)
如图,一定温度下,分别往容积均为 5L 的甲(恒压容器)、乙(恒容容器)中加入 0.5mol无色的N2O4气体,立即出现红棕色.当反应进行到 2s时,测得乙容器中N2O4的浓度为 0.09mol?L-1.经过 60s,乙容器中的反应达到平衡.(反应过程中两个容器的温度均保持恒定)湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com