
题目列表(包括答案和解析)
将CaCl2溶液与Na2CO3溶液混合,有关反应的离子方程式书写正确的是 ( )
A.Na2CO3 + Ca2+ === CaCO3 ↓+ 2Na2+ B. CO32- + Ca2+ === CaCO3 ↓
C. CaCl2 + CO32- === CaCO3 ↓+ 2Cl- D. Cl- + Na+ === NaCl
| 物质 温度 |
活性炭(mol) | NO(mol) | E(mol) | F(mol) |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
2- 3 |
- 3 |
- 3 |
2- 3 |
2- 3 |
- 3 |
2- 3 |
- 3 |
(16分)请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)我国储氢纳米碳管研究已取得重大进展。用电弧法合成的碳纳米管中常伴有大量碳
纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
___C + ___K2Cr2O7 + _______=" ___" CO2↑ + ___K2SO4 + ___Cr2(SO4)3 +___H2O
请完成并配平上述化学方程式。
(2)工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+ 2H2(g)  CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
①下列措施中有利于增大该反应的反应速率的是____________。
| A.使用高效催化剂 | B.降低反应温度 |
| C.增大体系压强 | D.不断将CH3OH从反应混合物中分离出来 |
 △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1(16分)请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)我国储氢纳米碳管研究已取得重大进展。用电弧法合成的碳纳米管中常伴有大量碳
纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
___C + ___K2Cr2O7 + _______= ___ CO2↑ + ___K2SO4 + ___Cr2(SO4)3 +___H2O
请完成并配平上述化学方程式。
(2)工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+ 2H2(g)  CH3OH(g)
△H1=-116 kJ·mol-1
CH3OH(g)
△H1=-116 kJ·mol-1
①下列措施中有利于增大该反应的反应速率的是____________。
A.使用高效催化剂 B.降低反应温度
C.增大体系压强 D.不断将CH3OH从反应混合物中分离出来
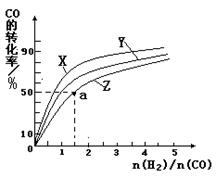
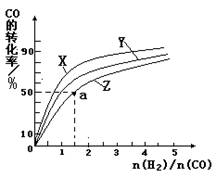
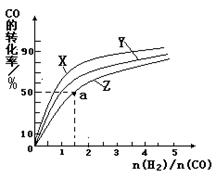
②在恒容容器中合成甲醇,当温度分别为230℃、250℃和270℃时,CO的转化率与n(H2)/n(CO)的起始组成比的关系如右图所示。已知容器体积1L,起始时CO的物质的量均为1mol。据此判断在上述三种温度中,曲线Z对应的温度是__________;利用图中a点对应的数据,计算该反应在对应温度下的平衡常数K =_______________________。
③已知: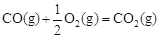 △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1
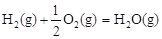 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气的热化学方程式为_________。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其溶度积常数Ksp=
c(Ca2+)·c(CO32—)=2.8×10−9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为5.6×10 -5 mol/L ,则生成沉淀所需CaCl2溶液的最小浓度为________________________。
 CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1| A.使用高效催化剂 | B.降低反应温度 |
| C.增大体系压强 | D.不断将CH3OH从反应混合物中分离出来 |
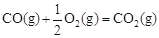 △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1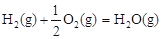 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com