
题目列表(包括答案和解析)
用标准的相加酸滴定未知氢氧化钠溶液,下列操作将对c(NaOH)有何影响?(填偏高、偏低或无影响)
(1)滴定前对酸式滴定管读数时,视线低于水平线,滴定结束时读数正确 。
(2)预先未用标准盐酸溶液润洗酸式滴定管 。
(3)滴定前锥形瓶中残留少量蒸馏水,就向锥形瓶中加待测液 。
(4)酸式滴定管未赶气泡就开始滴定,滴定结束后气泡消失 。
A.用盐酸滴定氢氧化钠时,滴定前,酸式滴定管内无气泡,滴定后产生气泡
B.用盐酸滴定氢氧化钠时,用甲基橙作指示剂,接近滴定终点,溶液由黄色转变为橙色,但不足半分钟又转为黄色,继续滴加盐酸,溶液颜色又转变为橙色,持续半分钟后颜色不变
C.某学生要配制0.1 mol·L-1的稀H2SO4 100 mL,当加蒸馏水到离容量瓶刻度线1—2 cm处时,改用胶头滴管滴加,结果不慎使液面稍稍超过刻度线一点,将多余部分吸出,使凹液面最低点与刻度线相切
D.物质的量浓度为0.05 mol·L-1的NaOH标准溶液因与空气接触吸收了少量CO2,用此标准液滴定未知物质的量浓度的HCl溶液
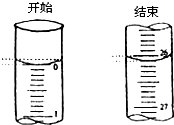 某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:| 滴定次数 | 待测氢氧化钠 溶液的体积/mL |
0.1000mol/L盐酸的体积(mL) | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
(14分)(1)某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂。请填写下列空白:
①用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视____ _。直到因加入一滴盐酸后,溶液由红色变为无色,并且__ _ 为止;
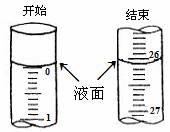
②若滴定开始和结束时,酸式滴定管中的液面如图所示:则所滴定盐酸的体积为_________mL;
(2)有一学生在实验室测某溶液的pH。实验时,他先用蒸馏水润湿pH试纸,然后用洁净的玻璃棒蘸取试样进行检测。
①该学生的操作是 (正确或错误)。
 ②如不正确,请分析是否一定有误差,为什么? 。
②如不正确,请分析是否一定有误差,为什么? 。
③若用此法分别测定c(H+)相同的盐酸和醋酸的稀溶液的pH,误差较大的是 ___________,原因是 。
K3[Fe(C2O4)3]·3H2O [三草酸合铁(Ⅲ)酸钾晶体]易溶于水,难溶于乙醇,可作为有机反应的催化剂。实验室可用铁屑为原料制备,相关反应过程如下,请回下列问题:

(1)铁屑中常含硫元素,因而在制备FeSO4时会产生有毒的H2S气体,该气体可用氢氧化钠溶液吸收。下列吸收装置正确的是 。

(2)在得到的FeSO4溶液中需加入少量的H2SO4酸化,目的是 ,得到K3[Fe(C2O4)3]溶液后,加入乙醇的目的是 。
(3)晶体中所含结晶水可通过重量分析法测定,主要步骤有:①称量,②置于烘箱中脱结晶水,③冷却,④称量,⑤重复②~④至恒重,⑥计算。
步骤③需要在干燥器中进行的原因是 ;
步骤⑤的目的是 。
(4) 可被酸性KMnO4溶液氧化放出CO2气体,所以实验产物中K3[Fe(C2O4)3]·3H2O含量测定可用KMnO4标准溶液滴定。
可被酸性KMnO4溶液氧化放出CO2气体,所以实验产物中K3[Fe(C2O4)3]·3H2O含量测定可用KMnO4标准溶液滴定。
①写出滴定过程中发生反应的离子方程式 ;
②下列滴定操作中使滴定结果偏高的是 ;
A.滴定管用蒸馏水洗涤后,立即装入标准液
B.锥形瓶在装待测液前未用待测液润洗
C.滴定前滴定管尖嘴处有气泡,滴定后气泡消失
D.读取标准液体积时,滴定前仰视读数,滴定后俯视读数
③取产物10.0g配成100mL溶液,从中取出20mL于锥形瓶中,用浓度为0.1mol·L-1酸性KMnO4溶液滴定,达到滴定终点时酸性KMnO4溶液消耗24mL,计算产物中K3[Fe(C2O4)3]·3H2O的质量分数 。[已知摩尔质量M(K3[Fe(C2O4)3]·3H2O)=491g·mol-1]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com