
题目列表(包括答案和解析)
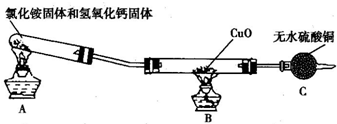
(1)实验时,甲同学选用硝酸银溶液作试剂A,乙同学选用氯化钡溶液作试剂A,其中________ (填“甲”或“乙”)同学选择的试剂A不合理,其理由是 。?
(2)以下都是正确选择试剂A时进行的实验:?
①为进行称量、溶解、反应、过滤、洗涤沉淀的各项操作,准备了以下仪器:托盘天平与砝码、过滤器、铁架台及附件、胶头滴管、量筒,其中还缺少的必备仪器是 。?
②若过滤所得沉淀未经洗涤即烘干称量,测出的氯化铵的质量分数 (填“偏高”“偏低”或“不变”)。?
③检验加入的试剂A是否过量的方法是 。?

下列有关实验的叙述正确的是
| A.已知Cu2O+2H+=Cu2++Cu+H2O,氢气还原氧化铜后生成的红色固体能完全溶于稀硝酸,说明还原产物是铜 |
| B.在中和热测定的实验中,将NaOH溶液和盐酸混合反应后的冷却温度作为末温度 |
| C.仅用淀粉溶液、稀硫酸、碘水、新制氢氧化铜四种试剂可完成淀粉水解产物及水解程度检验的探究实验 |
| D.向盛有少量Mg(OH )2悬浊液的试管中滴加氯化铵溶液,可以看到沉淀溶解 |
| A.已知Cu2O+2H+=Cu2++Cu+H2O,氢气还原氧化铜后生成的红色固体能完全溶于稀硝酸,说明还原产物是铜 |
| B.在中和热测定的实验中,将NaOH溶液和盐酸混合反应后的冷却温度作为末温度 |
| C.仅用淀粉溶液、稀硫酸、碘水、新制氢氧化铜四种试剂可完成淀粉水解产物及水解程度检验的探究实验 |
| D.向盛有少量Mg(OH )2悬浊液的试管中滴加氯化铵溶液,可以看到沉淀溶解 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com