
题目列表(包括答案和解析)
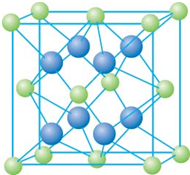 已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B形成的晶体其晶胞结构如图,图中小球代表D,大球代表B.请回答:
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B形成的晶体其晶胞结构如图,图中小球代表D,大球代表B.请回答: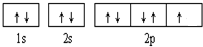



| 4×78g/mol |
| ag/cm3×6.02×1023/mol |
| 4×78g/mol |
| ag/cm3×6.02×1023/mol |
(16分)已知A、B、C、D、E、F、G和H都是元素周期表中前36号的元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的两倍,C的基态原子核外有7种不同运动状态的电子,E是电负性最大的元素,F的氢化物和最高价氧化物对应的水化物均为强酸,G、H分别是周期表中1—18纵列中的第10、12纵列元素。请回答下列问题:
(1)D元素在周期表位置是 ,G的核外价层电子排布式为 。
(2)E与A形成的化合物比F与A形成的化合物的沸点 (填“高”或“低”),其原因是 。
(3)B、C原子的第一电离能较大的是 (填元素符号),其原因是 。
(4)BD32-离子中B原子采取 杂化,任写一种与BD互为等电子体的分子的电子式 。
(5)元素H的一种硫化物晶体的晶胞结构如图所示,该硫化物的化学式是 。元素H的氢氧化物可溶于氨水中,生成和铜氨配离子相同配位数的离子,写出该反应的离子方程式为 。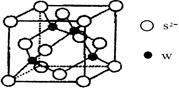
(1)写出甲与乙反应的化学方程式:__________________________________________;
(2)写出C、D、F的简单离子符号并按半径由大到小排列:___________________________;
(3)B与E形成的化合物BE2是_________________________(填空间构型)型分子,用电子式表示BE2的形成过程:_____________________________________________;
(4)写出C、E、G最低价氢化物的化学式并按熔点由低到高排列:______________________;
(5)写出丁与丙反应的化学方程式:__________________________________________。
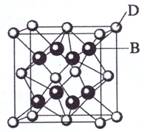
(10分)已知A、B、C、D、E都是元素周期表中前36号的元素,其原子序数依次增大。A与其他4种元素既不在同一周期又不在同一族。B和C属同一主族,D和E属同一周期,又知E是周期表中1—18列中的第8列元素。D的原子序数比E小6,D跟B可形成离子化合物其晶胞结构如右图。请回答:
(1)A与B形成的化合物在固态时的晶体类型是 ;A与B形成的化合物比A与C形成的化合物熔点要____(填高、低)
(2)写出C的单质与水反应的离子方程式 ;
(3)如图所示,D跟B形成的离子化合物的化学式为 ;鉴别该离子化合物是否为晶体,最可靠的科学方法是 ,该离子化合物晶体的密度为ag·cm-3,B、D两元素的相对原子质量分别为b、c,则晶胞的体积是 cm3(只要求列出算式)。
【解析】在前36号元素中,符合周期表中1—18列中的第8列元素的是铁,即E是铁,则D是Ca。根据D跟B形成离子化合物晶胞结构可判断,该离子化合物是DB2,则B是F或Cl。因为B和C属同一主族,且原子序数前者小于后者,所以B只能是F,C是Cl,A与其他4种元素既不在同一周期又不在同一族,所以A是H。
(1)HF属于分子晶体,由于HF中含有氢键,所以HF的沸点高于氯化氢的。
(2)氯气溶于水生成盐酸和次氯酸。
(3)鉴别离子化合物是否为晶体,最可靠的科学方法是射线衍射法。在该晶胞中含有的该离子是8×1/8+6×1/2=4,则F-是8,所以晶胞的体积是(8b+4c)/a NA。
(10分)已知A、B、C、D、E都是元素周期表中前36号的元素,其原子序数依次增大。A与其他4种元素既不在同一周期又不在同一族。B和C属同一主族,D和E属同一周期,又知E是周期表中1—18列中的第8列元素。D的原子序数比E小6,D跟B可形成离子化合物其晶胞结构如右图。请回答:
 (1)A与B形成的化合物在固态时的晶体类型是
;A与B形成的化合物比A与C形成的化合物熔点要____(填高、低)
(1)A与B形成的化合物在固态时的晶体类型是
;A与B形成的化合物比A与C形成的化合物熔点要____(填高、低)
(2) 写出C的单质与水反应的离子方程式
;
写出C的单质与水反应的离子方程式
;
(3)如图所示,D跟B形成的离子化合物的化学式为 ;鉴别该离子化合物是否为晶体,最可靠的科学方法是 ,该离子化合物晶体的密度为ag·cm-3,B、D两元素的相对原子质量分别为b、c,则晶胞的体积是 cm3(只要求列出算式)。
【解析】在前36号元素中,符合周期表中1—18列中的第8列元素的是铁,即E是铁,则D是Ca。根据D跟B形成离子化合物晶胞结构可判断,该离子化合物是DB2,则B是F或Cl。因为B和C属同一主族,且原子序数前者小于后者,所以B只能是F,C是Cl,A与其他4种元素既不在同一周期又不在同一族,所以A是H。
(1)HF属于分子晶体,由于HF中含有氢键,所以HF的沸点高于氯化氢的。
(2)氯气溶于水生成盐酸和次氯酸。
(3)鉴别离子化合物是否为晶体,最可靠的科学方法是射线衍射法。在该晶胞中含有的该离子是8×1/8+6×1/2=4,则F-是8,所以晶胞的体积是(8b+4c)/a NA。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com