
题目列表(包括答案和解析)
| 5 |
| 2 |
| 5 |
| 2 |
化学反应过程中发生物质变化的同时,常常伴有能量的变化。这种能量的变化常以热量的形式表现出来,叫做反应热。由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等。
(1)下列 △ H 表示物质燃烧热的是 (填字母编号)。
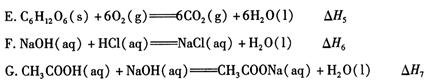
(2)依据上述热化学方程式,稀硝酸与氢氧化钾溶液发生中和反应的热化学方程式为 (其中热效应从上述 △H1 ~△H7尽中选取)。
(3)中和热的测定是高中化学的定量实验之一。 50 mL0.50 mol/L 盐酸与 50 mL 0.55 mol/L NaOH 溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。从实验装置上看,图中尚缺少的一种仪器是。大烧杯上如不盖硬纸板,求得的中和热数值将会(填“偏大”、“偏小”或“无影响”)。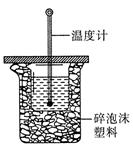
化学反应过程中发生物质变化的同时,常常伴有能量的变化。这种能量的变化常以热量的形式表现出来,叫做反应热。由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等。
(1)下列 △ H 表示物质燃烧热的是 (填字母编号)。
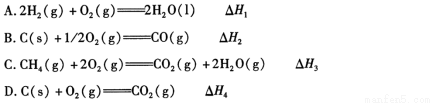
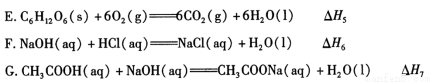
(2)依据上述热化学方程式,稀硝酸与氢氧化钾溶液发生中和反应的热化学方程式为 (其中热效应从上述 △H1 ~△H7 尽中选取)。
(3)中和热的测定是高中化学的定量实验之一。 50 mL0.50 mol/L 盐酸与 50 mL 0.55 mol/L NaOH 溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。从实验装置上看,图中尚缺少的一种仪器是。大烧杯上如不盖硬纸板,求得的中和热数值将会(填“偏大”、“偏小”或“无影响”)。
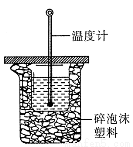
化学反应过程中发生物质变化的同时,常常伴随有能量的变化。这种能量的变化常以热能的形式表现出来,叫做反应热。由于反应的情况不同,反应热可以分为许多种,如燃烧热、中和热,等等。
(1)许多化学反应的反应热可以直接测量,其测量的仪器叫__________。
(2)下列ΔH表示物质燃烧热的是________;表示物质中和热的是_______。(填ΔH1、ΔH2、ΔH3…)

(3)充分燃烧一定量的丁烷放出的热量大小为Q,生成的CO2恰好与5mol?L-1100mLKOH溶液完全反应。求燃烧1mol丁烷放出的热量(设其数值为x)_______。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com