
题目列表(包括答案和解析)
(12分)接触法制硫酸的主要原料是硫铁矿和空气。
I、接触法制硫酸的过程中,三个最主要的设备是: 、 和吸收塔; 为了避免酸雾的形成,提高SO3的吸收率,工业上常用 来作吸收剂。
II、为了防止环境污染并对尾气进行综合利用,硫酸厂常用氨水吸收尾气中的SO2、SO3等气体,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。为了测定上述(NH4)2SO4 和NH4HSO4 固体混合物的组成,现称取该样品四份,分别加入浓度为3.00 mol·L-1的NaOH溶液50.00 mL,加热至120 ℃左右,使氨气全部逸出〔(NH4)2SO4和NH4HSO4的分解温度均高于200 ℃〕,测得有关实验数据如下(标准状况):
|
实验序号 |
样品的质量/g |
NaOH溶液的体积/mL |
氨气的体积/L |
|
1 |
3.62 |
50.00 |
0.896 |
|
2 |
7.24 |
50.00 |
1.792 |
|
3 |
10.86 |
50.00 |
2.016 |
|
4 |
14.48 |
50.00 |
1.568 |
(1)由第1组数据直接推测:用1.81 g样品进行同样实验时,生成氨气的体积(标准状况)
为 L。
(2)14.48g该混合物中n((NH4)2SO4)= mol n(NH4HSO4)= mol
(3)第4组中过量的NH4+ 的物质的量为: mol
(12分)接触法制硫酸的主要原料是硫铁矿和空气。
I、接触法制硫酸的过程中,三个最主要的设备是: 、 和吸收塔;为了避免酸雾的形成,提高SO3的吸收率,工业上常用 来作吸收剂。
II、为了防止环境污染并对尾气进行综合利用,硫酸厂常用氨水吸收尾气中的SO2、SO3等气体,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。为了测定上述(NH4)2SO4 和NH4HSO4 固体混合物的组成,现称取该样品四份,分别加入浓度为3.00 mol·L-1的NaOH溶液50.00 mL,加热至120 ℃左右,使氨气全部逸出〔(NH4)2SO4和NH4HSO4的分解温度均高于200 ℃〕,测得有关实验数据如下(标准状况):
| 实验序号 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L |
| 1 | 3.62 | 50.00 | 0.896 |
| 2 | 7.24 | 50.00 | 1.792 |
| 3 | 10.86 | 50.00 | 2.016 |
| 4 | 14.48 | 50.00 | 1.568 |
2008年10月14日长江商报报道:湖北监利钒污染致近千人患严重皮肤病。监利县有投产和在建的非法钒冶炼厂达9家,非法钒冶炼厂所造成的污染使得草木枯萎,饮水变咸,清河变浊,人畜奇怪病变,曾经的鱼米之乡正受到前所未有的污染威胁。钒和钒(V)的化合物在工业上有重要用途。如五氧化二钒是工业接触法制硫酸的催化剂。查阅资料知,利用钒矿石制五氧化二钒和钒的工艺流程图如下:
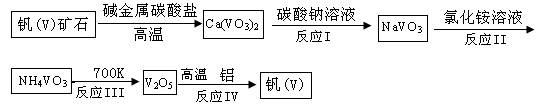
(1)钒(V)的原子序数为23,下列对钒在元素周期表中位置和元素类别判断正确的是 。
A.它位于第五周期第ⅤB族 B.它位于第四周期第ⅤB族 C.它是过渡元素
D.它位于第五周期第ⅤA族 E.它位于第四周期第ⅤA族 F.它与铁位于同一周期
(2)工业上,接触法制硫酸在接触室里发生反应:2SO2+O2![]() 2SO3,催化剂一般是V2O5??,下列对五氧化二钒作用的描述正确的是 。
2SO3,催化剂一般是V2O5??,下列对五氧化二钒作用的描述正确的是 。
A.能增大该反应所需要的能量 B.能提高二氧化硫的转化率
C.能改变该反应的反应热(△H) D.能同程度增大正、逆反应速率
E.能增加SO2和O2分子的能量
(3)写出下列化学方程式:
反应I: ;反应III: ;反应IV: 。
(4)预测反应II发生的原因是 ;IV的反应类型是 。
(18分)硫酸是化学工业最重要的产品之一,工业制法如下。
(1)生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧。反应的化学方程式为:2FeSO4·7H2O Fe2O3+SO2+SO3↑+14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管
Fe2O3+SO2+SO3↑+14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管 。
。
①试管b中得到的主要产物是 ,检验该产物的方法是(结合离子方程式简要说明) 。
②为检验反应的另一种生成物,试管c中应加入的试剂是 ,简述相应的实验现象及结论 。
③所得硫酸的理论浓度(溶质的质量分数)为 。
(2)目前,我国采用“接触法”制硫酸,生产设备如图所示:
①图中设备A的名称是 ,a、b两处所含气体的化学式分别为 、 。
②有关接触法制硫酸的下列说法中,不正确的是 。
| A.二氧化硫的接触氧化在合成塔中发生 |
| B.吸收塔得到的硫酸浓度为98% |
| C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失4% |
D. B装置中反应的条件之一为较高温度是为了提高SO2的转化率 B装置中反应的条件之一为较高温度是为了提高SO2的转化率 |
 、⑤ 、⑥ (可不填满)。
、⑤ 、⑥ (可不填满)。(18分)硫酸是化学工业最重要的产品之一,工业制法如下。
(1)生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧。反应的化学方程式为:2FeSO4·7H2O Fe2O3+SO2+SO3↑+14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。
Fe2O3+SO2+SO3↑+14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。

①试管b中得到的主要产物是 ,检验该产物的方法是(结合离子方程式简要说明) 。
②为检验反应的另一种生成物,试管c中应加入的试剂是 ,简述相应的实验现象及结论 。
③ 所得硫酸的理论浓度(溶质的质量分数)为 。
(2)目前,我国采用“接触法”制硫酸,生产设备如图所示:

①图中设备A的名称是 ,a、b两处所含气体的化学式分别为 、 。
②有关接触法制硫酸的下列说法中,不正确的是 。
A. 二氧化硫的接触氧化在合成塔中发生
B.吸收塔得到的硫酸浓度为98%
C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失4%
D. B装置中反应的条件之一为较高温度是为了提高SO2的转化率
(3)随着化学工业的发展,“接触法”全面替代了“绿矾热分解法”,请你从综合效益的角度指出“接触法”制硫酸的优势:① 生产成本低、② 原料易得、③ 、④ 、⑤ 、⑥ (可不填满)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com