
题目列表(包括答案和解析)
下图是某些实验的部分装置,其中所注明的实验能达到实验目的的是( )
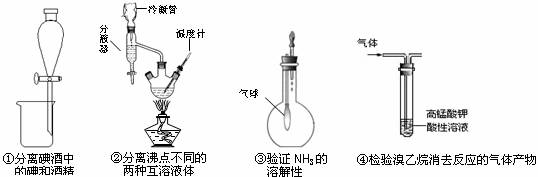
A.①② B.② ③ C.③ D.③ ④
下图是某些实验的部分装置,其中所注明的实验能达到实验目的的是 ( )
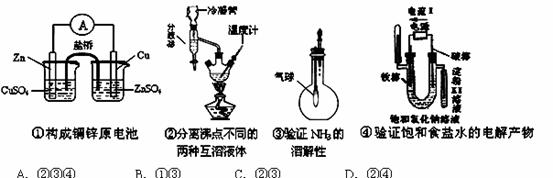
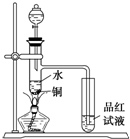 下面是某化学课外活动小组研究浓H2SO4的氧化性的结论并进行了实验验证:
下面是某化学课外活动小组研究浓H2SO4的氧化性的结论并进行了实验验证:(17分)图Ⅰ是化学实验室中常用制备、干燥气体的部分仪器装置。某学校同学利用中学常用试剂及仪器设计下列实验。

(1)图Ⅰ中仪器B的名称:_______________________。
(2)①同学甲利用图Ⅰ装置制备并收集干燥的NO2气体,请在方框内画出用集气瓶收集NO2的装置图(含尾气处理装置)。②B中发生反应的离子方程式为________________。
(3)同学乙利用图Ⅰ装置通过称量反应前后C的质量,确定Na2CO3和NaCl固体混合物中Na2CO3的质量。A中加入稀硫酸,B中加入Na2CO3和NaCl固体混合物,C中加入碱石灰。该装置存在较多缺陷,从而导致实验误差较大,请你说出其中的两点缺陷:
①______________________________________________________________________;
②______________________________________________________________________。
(4)同学丙利用图Ⅰ装置制取氨气和氧气的混合气体,并且利用图Ⅱ装置验证氨的某些性质。A中加入浓氨水,C中加入碱石灰,E内放置催化剂(铂石棉),按气流方向a→b→c→h连接各仪器。
①B内需加入固体试剂的名称为____________________,B中能产生氨气和氧气混合气体的原因是_______________________________________________________________。
②实验中观察到E内有红棕色气体出现,证明氨气具有_________性,E中发生反应的两个化学方程式为:____________________________和2NO + O2 == 2NO2。
(10分)下表是某城市某日的空气质量报告:
| 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
| 55 | SO2 | II | 良 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com