运用化学反应原理研究氮、硫、氯等单质及其化合物的反应有重要的意义.
(1)放热反应2SO
2(g)+O
2(g)=2SO
3(g)是硫酸工业上的重要反应,在体积不变的条件下,下列措施有利于提高SO
2平衡转化率的有
(填字母).
A、升高温度 B、降低温度 C、减小压强 D、加入催化剂 E.移出氧气
(2)氮是大气中含量最多的一种元素,氮及其化合物在工农业生产、生活中有着重要应用.用CH
4将氮氧化物(用NO
x表示)催化还原为N
2可以消除氮氧化物带来的污染,该反应的化学方程式为
.现有1L由NO、NO
2组成的混合气体,若将其还原为N
2、需同温同压下0.4LCH
4,则混合气体中NO、NO
2的物质的量之比为
.
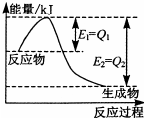
(3)如图是一定的温度和压强下,N
2和H
2反应生成1mol NH
3过程中的能量变化图,请写出工业合成氨的热化学方程式
.(△H的数值用含字母Q
1、Q
2的代数式表示).
(4)在25℃下,将xmol/L的氨水与y mol/L的盐酸等体积混合,反应后溶液显中性,则c(NH
4+ )
c(Cl
-)(填“>”、“<”或“=”);用含x和y的代数式表示该混合溶液中氨水的电离平衡常
.
(5)已知:25℃时,K
sp(AgCl)=1.8×10
-10、K
sp(AgBr)=4.9×10
-13.现在向0.001mol/L KBr和0.01mol/L KCl混合溶液中滴加0.1mol/L AgNO
3溶液(反应过程中溶液体积变化忽略不计),当出现AgCl沉淀时.c(Br
-)=
(保留两位有效数字).

![]() ,则混合气体中NO与NO2的体积比为 …( )
,则混合气体中NO与NO2的体积比为 …( ) 运用化学反应原理研究氮、硫、氯等单质及其化合物的反应有重要的意义.
运用化学反应原理研究氮、硫、氯等单质及其化合物的反应有重要的意义.