
题目列表(包括答案和解析)
原电池反应通常是放热反应,在理论上可设计成原电池的化学反应是
A.C(s)+H2O(g)= CO(g)+H2(g)
B.HCl + NaOH = NaCl + H2O
C.Ca(OH)2+2NH4Cl
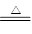 CaCl2 + 2NH3↑
+ 2H2O
CaCl2 + 2NH3↑
+ 2H2O
D.CH4(g)+2O2(g)= CO2(g)+2H2O(l)
原电池反应通常是放热反应,在理论上可设计成原电池的化学反应是
理由是 。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>O
B.C(s)+ CO2(g)= 2CO(g) △H>O
C.CaC2(s)+2H2O (g)=Ca(OH)2(l)+C2H2(g) △H<O
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H<O
| A.C(s)+H2O(g)= CO(g)+H2(g) |
| B.HCl + NaOH = NaCl + H2O |
C.Ca(OH)2+2NH4Cl 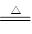 CaCl2 + 2NH3↑ + 2H2O CaCl2 + 2NH3↑ + 2H2O |
| D.CH4(g)+2O2(g)= CO2(g)+2H2O(l) |
原电池反应通常是放热反应,在理论上可设计成原电池的化学反应是
A.C(s)+H2O(g)= CO(g)+H2(g)
B.HCl +NaOH = NaCl + H2O
C.Ca(OH)2+2NH4Cl CaCl2 + 2NH3↑+ 2H2O
D.CH4(g)+2O2(g)= CO2(g)+2H2O(l)
原电池反应通常是放热反应,在理论上可设计成原电池的化学反应是
| A.C(s)+H2O(g)= CO(g)+H2(g) |
| B.HCl + NaOH = NaCl + H2O |
C.Ca(OH)2+2NH4Cl 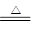 CaCl2 + 2NH3↑ + 2H2O CaCl2 + 2NH3↑ + 2H2O |
| D.CH4(g)+2O2(g)= CO2(g)+2H2O(l) |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com