
题目列表(包括答案和解析)
如图所示,图1、图2为中学化学常见的气体发生装置。
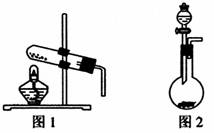
①若用图1装置制备氨气,写出化学方程式 。
②若用图2装置制备氨气,写出所需试剂名称 。
③若用图2装置制备氧气,写出化学方程式 。
(9分)如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(实验均在常温常压下进行)。![]()
实验序号 | 甲针筒内的物质 | 乙针筒内的物质 |
1 | 0.3gNa2CO3粉末 | 3mL稀HCl |
2 | 0.3gNaHCO3粉末 | 3mL稀HCl |
3 | 0.8gNa2O2粉末 | 3ml H2O |
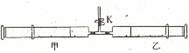
(1)实验1和实验2中,已知稀HCl均过量且质量分数相同,发生反应后,针筒活塞均_________(填“向外”、“向内”或“不”)移动。活塞移动较快的是______(填“实验1”或“实验2”)。
(2)①实验3中的实验现象是:剧烈反应,针筒活塞迅速_____(填“向外”、“向内”或“不”)移动。反应后将针筒置于空气中使其温度慢慢恢复至常温,发现此过程中针筒活塞慢慢向内移动,此现象说明实验3的反应为______(填“放热”或“吸热”)反应。
②实验3反应后甲针筒内有少量气体,检验该气体的操作及现象是:![]()
操作:打开弹簧夹K,压缩活塞使气体慢慢导出,________________________________________________。
现象:_______________________________________。
③旋转甲、乙两个针筒,使中间导管口朝下,打开弹簧夹K,移动活塞,将实验3针筒中溶液压入滴有酚酞的20mL水中,溶液立即显_______色,写出实验3发生反应的化学方程式:___________________________________。
 某中学化学实验室要求学生在实验室条件下,用标准卷尺、中学化学实验室常用的托盘天平和如图所示的仪器,再用稀硫酸和宽度、厚度均匀的纯镁带(镁带每米质量为2.5g左右)测定气体摩尔体积.假如实验是在标准状况下进行,试回答下列问题:
某中学化学实验室要求学生在实验室条件下,用标准卷尺、中学化学实验室常用的托盘天平和如图所示的仪器,再用稀硫酸和宽度、厚度均匀的纯镁带(镁带每米质量为2.5g左右)测定气体摩尔体积.假如实验是在标准状况下进行,试回答下列问题: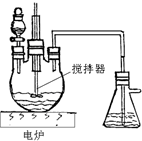
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com