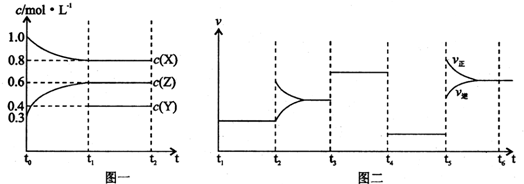
向一体积不变的密闭容器中加入2mol A、0.6mol C和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图一所示.图二为t
2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件.已知t
3~t
4阶段使用了催化剂;图一中t
0~t
1阶段c(B)未画出.

(1)若t
1=15min,则t
0~t
1阶段以C浓度变化表示的反应速率为v(C)=
0.02mol/(L?min)
0.02mol/(L?min)
.
(2)t
4~t
5阶段改变的条件为
减小压强
减小压强
,B的起始物质的量为
1.0mol
1.0mol
.
(3)判断图一中可逆反应达到平衡状态的依据是(填序号)
④
④
.
①2v
正(A)=3v
逆(C)
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④A、B、C的浓度都不再发生变化
(4)t
5~t
6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为a kJ,写出此温度下该反应的热化学方程式:
2A(g)+B(g)

3C(g)△H=+200akJ/mol
2A(g)+B(g)

3C(g)△H=+200akJ/mol
.
(5)在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,要达到t
1时刻同样的平衡,a、b、c要满足的条件为
.

 3C(g)
3C(g) 3C(g)
3C(g)
 3C(g)△H=+200akJ/mol
3C(g)△H=+200akJ/mol 3C(g)△H=+200akJ/mol
3C(g)△H=+200akJ/mol
 3C(g)△H=+200akJ/mol
3C(g)△H=+200akJ/mol 3C(g)△H=+200akJ/mol
3C(g)△H=+200akJ/mol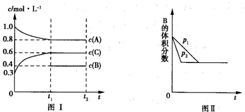 向一体积不变的密闭容器中加入2mol A、0.6mol C和一定量的B三种气体.一定条件下发生反应,各物质的物质的量浓度随时间变化的曲线如图Ⅰ所示.若保持其他条件不变,压强分别为p1和p2时,B的体积分数与时间的关系曲线如图Ⅱ所示.下列结论正确的是( )
向一体积不变的密闭容器中加入2mol A、0.6mol C和一定量的B三种气体.一定条件下发生反应,各物质的物质的量浓度随时间变化的曲线如图Ⅰ所示.若保持其他条件不变,压强分别为p1和p2时,B的体积分数与时间的关系曲线如图Ⅱ所示.下列结论正确的是( )