
题目列表(包括答案和解析)
为研究土壤的酸碱性,某学生做了如下实验:将一定体积的蒸馏水加入一定质量的土壤中,充分搅拌后,过滤并留取滤液,测滤液的pH后向滤液中滴加氨水,每加入2mL氨水就搅拌均匀并测量溶液的pH,所得实验记录如下,则所加入氨水的pH为( )
|
(共12分)在容积固定为2L的密闭容器中,充入0.180 molHI,480℃时反应:
2HI(g) H2(g)+I2(g),体系中n(HI)随时间变化情况如下表:
H2(g)+I2(g),体系中n(HI)随时间变化情况如下表:
|
t/min |
0 |
2 |
4 |
6 |
8 |
10 |
|
n(HI)/mol |
0.180 |
0.164 |
0.152 |
0.144 |
0.140 |
0.140 |
反应进行至10min后将反应混合物的温度降低,发现气体的颜色变浅。
(1)0~2min内H2的平均反应速度为 。达平衡时,HI的转化率是_________。(2)上述正向反应是: 反应(选填:放热、吸热)。
(3)某温度下上述反应平衡时,恒容、升高温度,原化学平衡向 反应方向移动(填“正”或“逆”),正反应速率 (填“增大”、“减小”或“不变”),容器内混合气体的压强 (填“增大”、“减小”或“不变”)。
(4)480℃时,反应H2(g)+I2(g) 2HI(g)的平衡常数K的值为 。
2HI(g)的平衡常数K的值为 。
(5)要增大反应2HI(g) H2(g)+I2(g)的平衡常数,可采取的措施是 (选填字母)。
H2(g)+I2(g)的平衡常数,可采取的措施是 (选填字母)。
A.增大HI起始浓度
B.向混合气体中通入I2
C.使用高效催化剂
D.升高温度
(共12分)在容积固定为2L的密闭容器中,充入0.180 molHI,480℃时反应:
2HI(g)H2(g)+I2(g),体系中n(HI)随时间变化情况如下表:
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| n(HI)/mol | 0.180 | 0.164 | 0.152 | 0.144 | 0.140 | 0.140 |
反应进行至10min后将反应混合物的温度降低,发现气体的颜色变浅。
(1)0~2min内H2的平均反应速度为 。达平衡时,HI的转化率是_________。(2)上述正向反应是: 反应(选填:放热、吸热)。
(3)某温度下上述反应平衡时,恒容、升高温度,原化学平衡向 反应方向移动(填“正”或“逆”),正反应速率 (填“增大”、“减小”或“不变”),容器内混合气体的压强 (填“增大”、“减小”或“不变”)。
(4)480℃时,反应H2(g)+I2(g)2HI(g)的平衡常数K的值为 。
(5)要增大反应2HI(g)H2(g)+I2(g)的平衡常数,可采取的措施是 (选填字母)。
A.增大HI起始浓度
B.向混合气体中通入I2
C.使用高效催化剂
D.升高温度
某校兴趣小组对氢氧化钠溶液和稀盐酸混合后的有关问题,进行了如下探究:
Ⅰ.(1)甲同学为了证明氢氧化钠溶液与稀盐酸能够发生反应,设计并完成了如图所示
实验。
X溶液是 ,滴入的量一般为 。
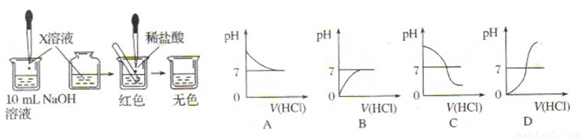
(2)乙同学也设计完成了另一个实验,证明氢氧化钠溶液与盐酸能够发生反应。在盛有氢氧化钠溶液的试管中,用胶头滴管慢慢滴入稀盐酸,不断振荡溶液,同时测定溶液的pH,直至盐酸过量。
①写出测定溶液pH的方法: 。
②上图中哪个图像符合该同学的记录 (填序号)。
(3)你认为甲、乙两位同学的实验中, (填“甲同学”、“乙同学”或“甲、乙两同学”)的实验能充分证明氢氧化钠溶液与盐酸发生了反应,请说明理由: 。
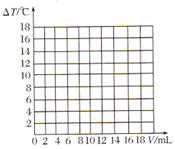
Ⅱ.丙同学测出10mL 10%的NaOH溶液和不同体积的10%的盐酸溶液混合过程中,溶液的温度变化见下表(假设两溶液密度相同)。
|
加入盐酸的 体积( |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
16 |
18 |
|
溶液温度上升 |
5.2 |
9.6 |
12.0 |
16.0 |
18.2 |
16.7 |
15.7 |
14.7 |
13.7 |
就此实验回答:
(4)盐酸和氢氧化钠的反应是 (填“吸热”或“放热”)反应。
(5)请在图中绘制出溶液的温度上升与加入盐酸体积之间的变化关系图,并在曲线上画出能表示两者之间恰好完全反应的点,并用字母P表示。
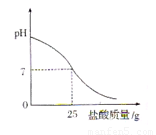
Ⅲ.丁同学为测定标示质量分数为32%的盐酸的实际质量分数,用pH测定仪组成实验装置。实验时先在烧杯中加入20g 40%的氢氧化钠溶液,再逐滴加入该盐酸,pH测定仪打印出加入盐酸的质量与烧杯中溶液的pH关系如图所示。
(6)请以此次测定的结果为依据计算该盐酸的实际质量分数为 。
(7)请分析你的计算结果与标签标示的质量分数不一致的可能原因(若一致,此空可不填): 。
某校兴趣小组对氢氧化钠溶液和稀盐酸混合后的有关问题,进行了如下探究:
Ⅰ.(1)甲同学为了证明氢氧化钠溶液与稀盐酸能够发生反应,设计并完成了如图所示
实验。
X溶液是 ,滴入的量一般为 。
(2)乙同学也设计完成了另一个实验,证明氢氧化钠溶液与盐酸能够发生反应。在盛有氢氧化钠溶液的试管中,用胶头滴管慢慢滴入稀盐酸,不断振荡溶液,同时测定溶液的pH,直至盐酸过量。
①写出测定溶液pH的方法: 。
②上图中哪个图像符合该同学的记录 (填序号)。
(3)你认为甲、乙两位同学的实验中, (填“甲同学”、“乙同学”或“甲、乙两同学”)的实验能充分证明氢氧化钠溶液与盐酸发生了反应,请说明理由: 。
Ⅱ.丙同学测出10mL 10%的NaOH溶液和不同体积的10%的盐酸溶液混合过程中,溶液的温度变化见下表(假设两溶液密度相同)。
| 加入盐酸的 体积( | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 |
| 溶液温度上升 | 5.2 | 9.6 | 12.0 | 16.0 | 18.2 | 16.7 | 15.7 | 14.7 | 13.7 |
就此实验回答:
(4)盐酸和氢氧化钠的反应是 (填“吸热”或“放热”)反应。
(5)请在图中绘制出溶液的温度上升与加入盐酸体积之间的变化关系图,并在曲线上画出能表示两者之间恰好完全反应的点,并用字母P表示。
Ⅲ.丁同学为测定标示质量分数为32%的盐酸的实际质量分数,用pH测定仪组成实验装置。实验时先在烧杯中加入20g 40%的氢氧化钠溶液,再逐滴加入该盐酸,pH测定仪打印出加入盐酸的质量与烧杯中溶液的pH关系如图所示。
(6)请以此次测定的结果为依据计算该盐酸的实际质量分数为 。
(7)请分析你的计算结果与标签标示的质量分数不一致的可能原因(若一致,此空可不填): 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com