
题目列表(包括答案和解析)
 O2(g)=H2O(l) ΔH3=-285.8kJ?mol-1
O2(g)=H2O(l) ΔH3=-285.8kJ?mol-1实验中不能直接测出由石墨和氢气生成甲烷反应的反应热,但可测出CH4、石墨和H2的燃烧热。试求出石墨生成甲烷的反应热。
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890.5kJ·mol-1;
C(石墨)+O2(g)= CO2(g) △H2=-393.5kJ·mol-1 ;
H2(g)+1/2O2(g)= H2O(l) △H3=-285.8kJ·mol-1。
求:C(石墨)+ 2H2(g)= CH4(g)△H4
实验室中不能直接测出由石墨和氢气生成甲烷反应的ΔH,但可测出CH4燃烧反应的ΔH.
已知:(1)CH4(g)+2O2(g)=CO2(g)+2H2)(l) ΔH1=-890.3 kJ·mol-1
(2)C(石墨,s)+O2(g)=CO2(g) ΔH2=-393.5 kJ·mol-1
(3)H2(g)+![]() O2(g)=H2O(g) ΔH3=-285.8 kJ·mol-1
O2(g)=H2O(g) ΔH3=-285.8 kJ·mol-1
求:C(石墨,s)+2H2(g)=CH4(g)的ΔH.
根据要求写出下列反应的热化学方程式
(1)一定量氢气与氯气反应生成氯化氢气体,当生成1mol氢氯键时放出91.5kJ的热量________________________________________________________.
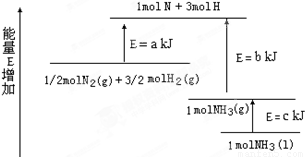
(2)某化学反应的能量变化如图所示,该反应的热化学方程式是(反应热用abc表示)
_____________________________________________.
(3)某反应的平衡常数 如果有1molN2 完全反应,要吸收热量68kJ.写出该反应的热化学方程式______________________________________________.
如果有1molN2 完全反应,要吸收热量68kJ.写出该反应的热化学方程式______________________________________________.
(4)实验中不能直接测出石墨和氢气生成甲烷反应的反应热,但可测出甲烷、石墨、氢气燃烧的反应热:
CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H1=-890.3kJ/mol
C(石墨,s)+O2(g)=CO2(g) ;ΔH2=-393.5 kJ/mol
H2(g)+1/2O2(g)=H2O(l) ;△H3=-285.8 kJ/moL
则由石墨与氢气反应生成甲烷的热化学反应方程式为__________________________________________.
根据要求写出下列反应的热化学方程式
(1)一定量氢气与氯气反应生成氯化氢气体,当生成1mol氢氯键时放出91.5kJ的热量________________________________________________________.
(2)某化学反应的能量变化如图所示,该反应的热化学方程式是(反应热用abc表示)
_____________________________________________.
(3)某反应的平衡常数如果有1molN2 完全反应,要吸收热量68kJ.写出该反应的热化学方程式______________________________________________.
(4)实验中不能直接测出石墨和氢气生成甲烷反应的反应热,但可测出甲烷、石墨、氢气燃烧的反应热:
CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H1=-890.3kJ/mol
C(石墨,s)+O2(g)=CO2(g);ΔH2=-393.5 kJ/mol
H2(g)+1/2O2(g)=H2O(l);△H3=-285.8kJ/moL
则由石墨与氢气反应生成甲烷的热化学反应方程式为__________________________________________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com