以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工.
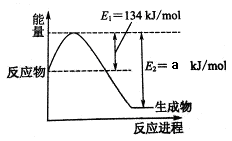
(1)将水蒸气通过红热的炭即可产生水煤气.反应为:C(s)+H
2O(g)?CO(g)+H
2(g)△H=+131.3kJ?mol
-1.
①该反应在常温下
不能
不能
自发进行(填“能”或“不能”);
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是
bd
bd
(填字母,下同).
a.容器中的压强不变 b.1mol H-H键断裂的同时,断裂2mol H-O键
c.c(CO)=c(H
2) d.密闭容器的容积不再改变
③若在一容积不变的密闭容器中,发生上述反应,充入N
2,则平衡
不
不
(填“正向”、“逆向”或“不”)移动.
若在一容积可变的密闭容器中,发生上述反应,充入N
2,则平衡
正向
正向
(填“正向”、“逆向”或“不”)移动.
(2)将不同量的CO(g)和H
2O(g)分别通入体积为2L的恒容密闭容器中,进行反应CO(g)+H
2O(g)?CO
2(g)+H
2(g),得到如下三组数据:
|
实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
|
H2O |
CO |
H2 |
CO |
|
1 |
650 |
2 |
4 |
1.6 |
2.4 |
6 |
|
2 |
900 |
1 |
2 |
0.4 |
1.6 |
3 |
|
3 |
900 |
a |
b |
c |
d |
t |
①实验1中以v(CO
2)表示的反应速率为
0.13mol/(L.min)
0.13mol/(L.min)
(取小数点后两位);
②该反应为
放热
放热
(填“吸热”或“放热”)反应,实验2的化学平衡常数K=
0.17
0.17
(取两位有效数字)
(3)目前工业上有一种方法是用CO
2来生产甲醇.一定条件下发生反应:
CO
2(g)+3H
2(g)?CH
3OH(g)+H
2O(g)△H<0.在体积为1L的恒容密闭容器中,充入1mol CO
2和3mol H
2,下列条件能使上述反应的反应速率增大,且平衡向正反应方向移动的是
c
c
(填写序号字母).
a.及时分离出CH
3OH气体
b.适当升高温度
c.保持容器的容积不变,再充入1mol CO
2和3mol H
2d.选择高效的催化剂.

 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据: