
题目列表(包括答案和解析)

| ||
| ||
| ||
| ||
| 3 |
| 4 |
| 3 |
| 4 |

| ||
| ||
| ||
| ||
| 3 |
| 4 |
| 3 |
| 4 |
 I.下列实验设计、操作或实验现象合理的是
I.下列实验设计、操作或实验现象合理的是| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
Ⅰ.下列实验操作中正确的是
A.分液时,分液漏斗下层液体从下端放出,上层液体从上口倒出
B.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
C.蒸发结晶时应将溶液直接蒸干
D.称量非腐蚀性药品应放在托盘天平左盘的称量纸上,砝码放在托盘天平右盘的称量纸上
Ⅱ.影响化学反应速率的因素很多,某学校化学小组用实验的方法进行探究。他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来探究影响化学反应速率的因素。甲同学的实验报告如下表:
|
实验步骤 |
现象 |
结论 |
|
①分别取等体积2mol/L的硫酸于试管中 ② |
Mg产生气泡速率快于Fe,Cu无明显变化 |
金属性质越活泼,反应速率越快 |
(1)甲同学表中实验步骤②为 。
(2)甲同学的实验目的是探究 。
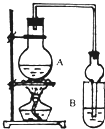
乙同学为了更精确地研究浓度对反应速率的影响,利用下图所示装置进行定量实验。

(3)乙同学在实验中应该测定的数据是 。
(4)乙同学完成实验应选用的实验药品是 。
(9分,每空1分)某课外活动小组对甲酸进行了如下的实验,以验证其含有醛基,并考察其化学性质,首先做了银镜反应.
(1)在甲酸进行银镜反应前,必须在其中加入一定量的 ,因为 ;
(2)写出甲酸进行银镜反应的化学方程式: ;
(3)某同学做银镜反应失败,他可能进行的错误操作有__ ______(写字母):
A.用洁净的试管;B.在浓度为2%的NH3·H2O中滴入稍过量的浓度为2%的硝酸银;
C.用临时配制好的银氨溶液;D.在银氨溶液里加入稍过量的甲酸;
E.反应过程中,没有振荡试管.
然后,同学们对甲酸与甲醇进行了酯化反应的研究:
(4)乙装置中长导管A的作用是 ;
(5)选择甲装置还是乙装置好?________,原因是 ;
(6)实验过程中选用的药品及试剂有:浓H2SO4、甲醇、甲酸还有________、________两种必备用品.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com