
题目列表(包括答案和解析)

A中放有
试回答下列问题:
(1)请写出在蒸发皿中制得莫尔盐的化学方程式:_________________________________。
(2)滴加稀硫酸时,发现其反应速率比同浓度硫酸与纯铁粉反应快,其原因是___________
_____________________________________。
(3)取
①配平下列反应式:
______Fe2++______![]() +______H+——______Mn2++______Fe3++______H2O
+______H+——______Mn2++______Fe3++______H2O
②用________(酸式或碱式)滴定管盛装高锰酸钾溶液。
③高锰酸钾溶液的物质的量浓度是________。
莫尔是一位著名分析化学家,以他命名的莫尔盐[ (NH4)2Fe(SO4)2?6H2O]是化学分析中重要的试剂,常作为一种稳定的还原剂使用。某同学模拟制备莫尔盐并利用莫尔盐测定高锰酸钾溶液的浓度。他的实验过程如下:
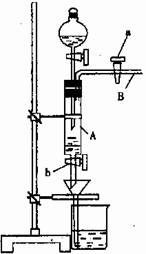
A中放有2g废铁屑(含铁锈,其他杂质不与稀硫酸反应),烧杯中盛有饱和硫酸铵溶液,实验时打开a,关闭b,从分液漏斗内向A中加一定量的稀硫酸,此时溶液呈浅绿色,再打开b进行过滤,过滤结束后取烧杯内溶液倒入蒸发皿中加热,蒸发掉部分水,再降温结晶获得莫尔盐晶体。然后用莫尔盐测定未知高锰酸钾溶液的浓度。
试回答下列问题:
(1)请写出在蒸发皿中制得莫尔盐的化学方程式是
。
(2)滴加稀H2SO4时,发现其反应速率比同浓度硫酸与纯铁粉反应快,其原因是
。
(3)取3.92g莫尔盐晶体配成100mL溶液,用酸式滴定管取20.00mL注入锥形瓶中,然后用未知浓度的酸性高锰酸钾溶液进行滴定,消耗该溶液的体积为8.00mL。
①配平下列反应式:
Fe2++ MnO4-+ H+ ― Mn2++ Fe3++ H2O
②用 (酸式或碱式)滴定管盛装高锰酸钾溶液
③高锰酸钾溶液的物质的量浓度是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com