
题目列表(包括答案和解析)
一般情况下,较强的氧化剂如:MnO2、KMnO4、KClO3、Ca(ClO)2等氧化浓盐酸时,有如下反应规律:氧化剂+浓盐酸→金属氯化物+水+氯气。实验室通常用该原理制取少量Cl2。
⑴ 从原子经济学角度出发,要使浓盐酸中Cl-充分转化为Cl2,制取等量的Cl2最好选用上述氧化剂中的 氧化浓盐酸。
⑵ 将214.5gCa(ClO)2放入500 mL 、12.0 mol/L的浓盐酸中,生成的Cl2在标准状况下的体积为39.2 L。若反应前后溶液的体积保持不变,计算反应后溶液中HCl的物质的量浓度。
⑶ 漂白粉是 Ca(ClO)2、CaCl2 ?Ca(OH)2 ?H2O 和 CaO 的混合物。漂白粉放出的氯气具有漂白作用,叫有效氯。通常用有效氯表示漂白粉的纯度。漂白粉中的有效氯含量常用滴定碘法进行测定,即在一定量的漂白粉中加入过量的KI ,加H2SO4酸化,有效氯与I-作用析出等量的I2,析出的I2以淀粉指示剂立即用Na2S2O3标准溶液滴定。若测定漂白粉中有效氯时用盐酸酸化,则盐酸的浓度应小于 mol/L,否则测定的有效氯将 (“偏高”、“偏低”或“不变”)。
一般情况下,较强的氧化剂[如MnO2,KMnO4,KClO3,K2Cr2O7,Ca(ClO)2等]氧化浓盐酸时,有如下反应规律:氧化剂+浓盐酸→金属氯化物+水+氯气.
现将A g漂粉精(过量)放入B L c mol/L的浓盐酸中反应,欲测定盐酸被漂粉精氧化的最低浓度D,需要测定反应生成Cl2的质量m或体积V.
(1)在图中选择正确且必要的仪器,装配成测量Cl2的装置(不含Cl2发生装置):
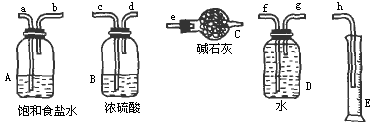
①测定Cl2的质量时各仪器接口的连接顺序为________;
②测定Cl2的体积时可选择的仪器有________(填编号).
(2)两种测量Cl2的方法,从操作上选择哪一种更简便________.
(3)若选择测量Cl2体积,则读数时应注意:①________,②________,③________.
(4)若选择测量Cl2的质量时结果测出的m偏大,则可能性的原因是(至少写两点):①________,②________.
一般情况下,较强的氧化剂
[如MnO2、KMnO4、KClO3、Ca(ClO)2等]与浓盐酸反应时会有如下规律:氧化剂+浓盐酸→金属氯化物+水+氯气.将214.5 g Ca(ClO)2投入500 mL 12.0 mol/L浓盐酸中,生成的Cl2在标准状况下的体积为39.2 L,同时也得到一种具有漂白性的稀溶液.若反应前后溶液的体积保持不变,计算反应后溶液中HCl的物质的量浓度.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com