
题目列表(包括答案和解析)
某学生为了测定部分变质的Na2SO3样品的纯度,设计了如下实验:
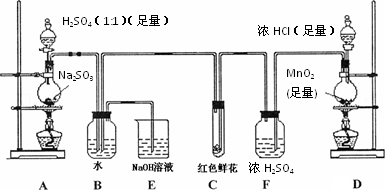
回答下列问题
(1)写出A装置中玻璃仪器的名称:酒精灯、___________________.
(2)实验开始后,写出B中反应的离子方程式___________________.
(3)C中的现象是___________,E装置的作用是___________________.
(4)按下图所示称取一定量的Na2SO3样品放入A装置的烧瓶中,滴入足量的H2SO4完全反应.然后将B中完全反应后的溶液与足量的BaCl2溶液反应,过滤、洗涤、干燥,得白色沉淀23.3 g,则原样品中Na2SO3的纯度为________(精确到0.1%).
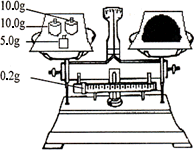
(5)在过滤沉淀时若过滤液出现浑浊,则必须要重复操作,若该学生没有重复过滤,则测定的结果将________(填偏高、偏低或无影响).
(6)要使测定结果准确,①装置气密性必须良好;②应先点燃________处酒精灯(填装置字母).
( 08鄞州中学限时训)某学生为了测定部分变质的Na2SO3样品的纯度,设计了如下实验:
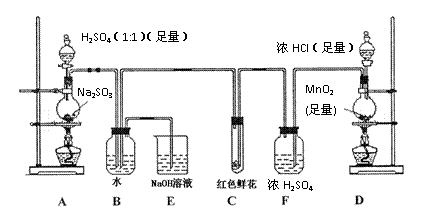 |
回答下列问题
(1)写出A装置中玻璃仪器的名称:酒精灯、 。
(2)实验开始后,写出B中反应的离子方程
式 。
(3)C中的现象是 ,E装置的作用是______。
(4)按右图所示称取一定量的Na2SO3样品放入A
装置的烧瓶中,滴入足量的H2SO4完全反应。然后
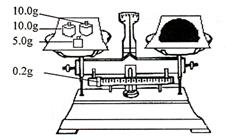
将B中完全反应后的溶液与足量的BaCl2溶液反应,
过滤、洗涤、干燥,得白色沉淀23.3g,则原样品中
Na2SO3的纯度为 (精确到0.1%)。
(5)在过滤沉淀时若过滤液出现浑浊,则必须要
重复操作,若该学生没有重复过滤,则测定的结果将 (填“偏高”、“偏低”或“无影响”)。
(6)要使测定结果准确,第一:装置气密性必须良好;第二:应先点燃 处酒精灯(填装置字母)。
Na2SO3在空气中易被氧化而变质。某同学为证明Na2SO3有还原性,从一瓶实验室长期存放的Na2SO3固体中取出少量溶于水,滴入一定量的烧碱溶液和少许溴水,振荡后溶液变为无色。
(1)在碱性溶液中Br2和Na2SO3反应的离子方程式 。
(2)反应后的溶液含有SO32-、SO42-、Br-、OH-等阴离子,下表是某同学鉴定其中SO32-、SO42-和Br-的实验报告,请完成未填完的部分。
限选试剂:2 mol·L-1HCl;1 mol·L-1 H2SO4;l mol·L-1BaCl2;l mol·L-1Ba(NO3)2;1 mol·L-1 KMnO4、CCl4;新制饱和氯水;品红溶液。
|
编号 |
实验操作 |
预期现象和结论 |
|
步骤①
|
取少量待测液加入试管中,加入过量2mol·L-1HCl,再滴加适量1 mol·L-1BaCl2 溶液。 |
有白色沉淀生成,证明待测液中含有、SO42- 。 |
|
步骤②
|
|
|
|
步骤③
|
|
|
(3)为了测定上述样品的纯度,现取10.0克试样配成250ml溶液。取出25.00ml所配溶液,用0.10mol/L的酸性KMnO4溶液滴定至终点。反应离子方程式为:
重复操作三次,每次消耗0.10mol/L KMnO4溶液体积分别为20.02 ml、 20.00 ml和19.98 ml。(相对原子质量Na 23 S 32 O 16)
①计算样品中Na2SO3的质量分数为 。(结果保留3位有效数字)
②操作时,若未用0.10mol/L的酸性KMnO4溶液润洗滴定管,会导致测定结果 。(填“偏高”、“偏低”或“没有影响”)


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com