
题目列表(包括答案和解析)
(15分)碱式碳酸铜的成分有多种,其化学式一般可表示为xCu(OH)2·yCuCO3。
(1)孔雀石呈绿色,是一种名贵的宝石,其主要成分是Cu(OH)2·CuCO3。某兴趣小组为探究制取孔雀石的最佳反应条件,设计了如下实验:
实验1:将2.0mL 0.50 mol·L–1的Cu(NO3)2溶液、2.0mL 0.50 mol·L–1的NaOH溶液和0.25 mol·L–1的Na2CO3溶液按表Ⅰ所示体积混合。
实验2:将合适比例的混合物在表Ⅱ所示温度下反应。
实验记录如下:
表Ⅰ 表Ⅱ
|
编号 |
V (Na2CO3)/mL |
沉淀情况 |
|
编号 |
反应温度/℃ |
沉淀情况 |
|
1 |
2.8 |
多、蓝色 |
|
1 |
40 |
多、蓝色 |
|
2 |
2.4 |
多、蓝色 |
|
2 |
60 |
少、浅绿色 |
|
3 |
2.0 |
较多、绿色 |
|
3 |
75 |
较多、绿色 |
|
4 |
1.6 |
较少、绿色 |
|
4 |
80 |
较多、绿色(少量褐色) |
①实验室制取少许孔雀石,应该采用的最佳条件是 。
②80℃时,所制得的孔雀石有少量褐色物质的可能原因是 。
(2)实验小组为测定上述某条件下所制得的碱式碳酸铜样品组成,利用下图所示的装置(夹持仪器省略)进行实验:
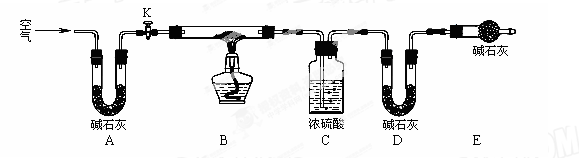
步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中。
步骤2:打开活塞K,鼓入空气,一段时间后关闭,称量相关装置的质量。
步骤3:加热装置B直至装置C中无气泡产生。
步骤4: (请补充该步操作内容)。
步骤5:称量相关装置的质量。
①装置A的作用是 ;若无装置E,则实验测定的x/y的值将 。(选填“偏大”、“偏小”或“无影响”)。
②某同学在实验过程中采集了如下数据:
A.反应前玻璃管与样品的质量163.8g B.反应后玻璃管中残留固体质量56.0g
C.装置C实验后增重9.0g D.装置D实验后增重8.8g
为测定x/y的值,你认为可以选用上述所采集数据中的 (写出所有组合的字母代号)任一组即可进行计算,并根据你的计算结果,写出该样品组成的化学式 。
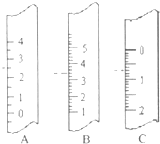 (1)如图分别是温度计、量筒、滴定管的一部分,则:
(1)如图分别是温度计、量筒、滴定管的一部分,则:(15分)某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
|
实验步骤 |
实验现象 |
|
将打磨过的铝片过量放入一定浓度的CuCl2溶液中 |
产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
|
反应结束后分离出溶液备用 |
|
|
红色固体用蒸馏水洗涤后,置于潮湿空气中 |
一段时间后固体由红色变为绿色[视其主要成分为 |
|
Cu2OH2CO3 |
|
按反应类型写出实验中发生反应的化学方程式各一个是离子反应的只写离子方程式
置换反应____________,
化合反应____________。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可观察到的现象是______________________________________________。
解释此现象的离子方程式是_______________。
(3)工业上可用铝与软锰矿主要成分为MnO2反应来冶炼金属锰。
① 用铝与软锰矿冶炼锰的原理是用化学方程式表示_____________________________。
② MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+,该反应的离子方程式______________________________。
(15分)碱式碳酸铜的成分有多种,其化学式一般可表示为xCu(OH)2·yCuCO3。
⑴孔雀石呈绿色,是一种名贵的宝石,其主要成分是Cu(OH)2·CuCO3。某兴趣小组为探究制取孔雀石的最佳反应条件,设计了如下实验:
实验1:将2.0mL 0.50 mol·L—1的Cu(NO3)2溶液、2.0mL 0.50 mol·L—1的NaOH溶液和0.25 mol·L—1的Na2CO3溶液按表Ⅰ所示体积混合。
实验2:将合适比例的混合物在表Ⅱ所示温度下反应。
实验记录如下:
| 编号 | V (Na2CO3)/ mL | 沉淀情况 | | 编号 | 反应温度/℃ | 沉淀情况 |
| 1 | 2.8 | 多、蓝色 | | 1 | 40 | 多、蓝色 |
| 2 | 2.4 | 多、蓝色 | | 2 | 60 | 少、浅绿色 |
| 3 | 2.0 | 较多、绿色 | | 3 | 75 | 较多、绿色 |
| 4 | 1.6 | 较少、绿色 | | 4 | 80 | 较多、绿色(少量褐色) |
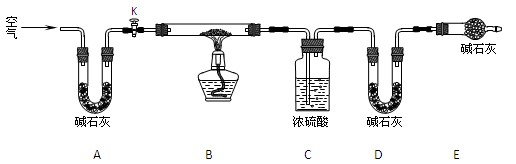
(15分)某课外小组对一些金属单质和化合物的性质进行研究。
(1?)下表为“铝与氯化铜溶液反应”实验报告的一部分:
| 实验步骤 | 实验现象 |
| 将打磨过的铝片?过量?放入一定浓度的CuCl2溶液中 | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
| 反应结束后分离出溶液备用 | |
| 红色固体用蒸馏水洗涤后,置于潮湿空气中 | 一段时间后固体由红色变为绿色[视其主要成分为 |
| Cu2?OH?2CO3 | |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com