
题目列表(包括答案和解析)
(16分)碳、氮、硫、氯是四种重要的非金属元素。
(1)CH4(g)在O2(g)中燃烧生成CO(g)和H2O(g)的△H难以直接测量,原因是?? ??????????? 。
已知:a.2CO(g)+O2(g)=2CO2(g)??? △H =-566.0 kJ·mol-1
b.CH4(g)+2O2(g)=CO2(g)+2H2O(g)?? △H =-890.0 kJ·mol-1
则CH4(g)在O2(g)中燃烧生成CO(g)和H2O(g)的热化学方程式为 ??????????????????????????????????? 。
(2)工业上合成氨气的反应为:N2(g)+3H2(g) 2NH3(g)? △H<0。现将10 mol N2和26 mol H2置于容积可变的密闭容器中,N2的平衡转化率(
2NH3(g)? △H<0。现将10 mol N2和26 mol H2置于容积可变的密闭容器中,N2的平衡转化率( )与体系总压强(P)、温度(T)的关系如图所示。回答下列问题:
)与体系总压强(P)、温度(T)的关系如图所示。回答下列问题:

①反应达到平衡状态B时,容器的容积10 L,则T1时,合成氨反应的平衡常数K= ???? L2·mol-1。
②平衡状态由A变到C时,对应的平衡常数K(A)??? K(C)(填“>”、“<”或“=”)。
(3)在25℃时,HSCN、HClO、H2CO3的电离常数如下表:
HClO | HSCN | H2CO3 |
K=3.210-8 | K=0.13 | Kl=4.210-7 K2=5.610-11 |
①1 mol·L-1的KSCN溶液中,所有离子的浓度由大到小的顺序为? ??? >????? > ??? > ???????? 。
②向Na2CO3溶液中加入过量HClO溶液,反应的化学方程式为 ??????? ? 。
③25℃时,为证明HClO为弱酸,某学习小组的同学没计了以下三种实验方案。下列三种方案中,你认为能够达到实验目的的是??? (填下列各项中序号)。
a.用pH计测量0.1 mol·L-1NaClO溶液的pH,若测得pH>7,可证明HClO为弱酸
b.用pH试纸测量0.01 mol·L-1HClO溶液的pH,若测得pH>2,可证明HClO为弱酸
c、用仪器测量浓度均为0.1 mol·L-1的HClO溶液和盐酸的导电性,若测得HClO溶液的导电性弱于盐酸,可证明HClO为弱酸
(16分)(Ⅰ)本世纪是生命科学研究的昌盛时期, 科学家研究发现,进入生物体内的氧分子,可接受1个电子转变为超氧阴离子自由基(O2-),进而引发产生一系列自由基。一切需氧生物在其机体内均有一套完整的活性氧系统(抗氧化酶和抗氧化剂),能将活性氧转变为活性较低的物质,机体因此受到保护。人们利用羟胺(NH2OH)氧化的方法可以检测其生物系统中O2-含量,原理是O2-与羟胺反应生成NO2-和一种过氧化物。NO2-在对氨基苯磺酸和α-萘胺作用下,生成粉红的偶氮染体,染体在波长530nm处有显著吸收,且其吸收值与c(NO2-)成正比,从而可计算出样品中的O2-含量。某实验室用以上方法处理后测得溶液中c(NO2-)=2.500×10-3 mol?L-1。
科学家研究发现,进入生物体内的氧分子,可接受1个电子转变为超氧阴离子自由基(O2-),进而引发产生一系列自由基。一切需氧生物在其机体内均有一套完整的活性氧系统(抗氧化酶和抗氧化剂),能将活性氧转变为活性较低的物质,机体因此受到保护。人们利用羟胺(NH2OH)氧化的方法可以检测其生物系统中O2-含量,原理是O2-与羟胺反应生成NO2-和一种过氧化物。NO2-在对氨基苯磺酸和α-萘胺作用下,生成粉红的偶氮染体,染体在波长530nm处有显著吸收,且其吸收值与c(NO2-)成正比,从而可计算出样品中的O2-含量。某实验室用以上方法处理后测得溶液中c(NO2-)=2.500×10-3 mol?L-1。
⑴ 请根据测定原理写出有关反应的离子方程式 ▲ ;
⑵ 计算该样品此时c(O2-) = ▲ ;
⑶ 如用羟胺氧化法测定O2-时,将其生成的过氧化物作为检测物,若选用氧化还原法进行定量分析(用KMnO4标准溶液进行滴定)
① 请写出其测定原理的反应方程式 ▲ ;
② 测定所用的主要玻璃仪器为 ▲ ,通过观察 ▲ 的现象可确定测定反应是否进行完全。
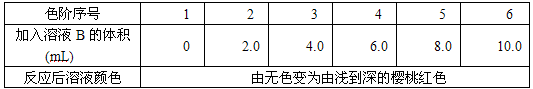
(Ⅱ)水中的NO2-是含氮有机物分解的产物,其浓度的大小是水源污染的标志之一。检测水中的NO2-可用比色法,其步骤是:
a. 配制标准溶液:称取0.30gNaNO2,溶于水后在容量瓶中稀释至1L得溶液A,移取5mL溶液A,稀释至1L,得溶液B。
b. 配制标准色阶:取6只规格为10mL的比色管(即质地、大小、厚薄相同且具塞的平
底试管),分别加入体积不等的溶液B,并稀释至10mL,再加入少许(约0.3g)对苯磺酸粉末,实验结果如下表所示:
| 色阶序号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 加入溶液B的体积(mL) | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 10.0 |
| 反应后溶液颜色 | 由无色变为由浅到深的樱桃红色 | |||||
在800℃密闭容器中进行反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),若CO的起始浓度为1.0×10-2mol?L-1,水蒸气的起始浓度为3.0×10-2mol?L-1,达到平衡后,实验测得CO2浓度为7.5×10-3mol?L-1。
CO2(g)+H2(g),若CO的起始浓度为1.0×10-2mol?L-1,水蒸气的起始浓度为3.0×10-2mol?L-1,达到平衡后,实验测得CO2浓度为7.5×10-3mol?L-1。
(1)计算800℃,1.0×105Pa条件下,上述反应的平衡常数K= 。
(2)800℃,1.0×105Pa条件下,起始时在上述容器中加入1molCO、1molH2O、2molH2、2molCO2,则此反应的初始状态 (填“是”、“否”)为平衡状态;若是平衡状态不必做答,若不是平衡状态,反应将向 (填“正”、“逆”)反应方向进行以达到化学平衡状态。
(3)在800℃,1.0×105Pa条件下,将4molCO和4molH2O投入密闭容器中进行上述反应,达到平衡后,H2的物质的量为a mol,CO的转化率为α,则a= ,α= 。
| 主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 | |
| 2 | ① | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | |||||

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com