
题目列表(包括答案和解析)

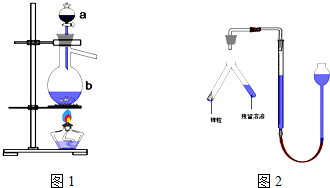
图中:①为氯气发生装置;②的试管里盛有15 mL30%的KOH溶液,并置于水浴中;③的试管里盛有15 mL 8%的NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;
请填写下列空白:
(1)辅导老师提示该装置需进一步完善:
Ⅰ.应在①与②之间安装盛有(填试剂名称)______________的净化装置;
Ⅱ.还需增加一装置,请画出增加部分的装置示意图,并注明所盛试剂名称。
(2)写出②中Cl2与KOH溶液反应的化学方程式(不必配平)______________。
(3)④的试管中溶液的颜色应先变为______________色,随后逐渐变为无色,又从无色逐渐变为______________色。
(4)实验结束时,应先熄灭______________处的酒精灯,对①的烧瓶中残存气体的处理方法是______________。
(5)84消毒液的有效成分是NaClO,此消毒液不仅能杀菌消毒,还能使有色物质褪色,其原理是______________(用化学方程式表示)。
(08山东省滨州市质检)(16分)某实验小组在实验室用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。

图中:①为氯气发生装置;②的试管里盛有15mL30%的KOH溶液,并置于水浴中;③的试管里盛有15mL 8%的NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;
请填写下列空白:
(1)辅导老师提示该装置需进一步完善:
I.应在①与②之间安装盛有(填试剂名称) 的净化装置;
II.还需增加一装置,请画出增加部分的装置示意图,并注明所盛试剂名称。
(2)写出②中Cl2与KOH溶液反应的化学方程式(不必配平) 。
(3)④的试管中溶液的颜色应先变为 色,随后逐渐变为无色,又从无色逐渐变为 色。
(4)实验结束时,应先熄灭 处的酒精灯,对①的烧瓶中残存气体的处理方法是 。
(5)84消毒液的成效成分是NaClO,此消毒液不仅能杀菌消毒,还能使有色物质褪色,其原理是(用化学方程式表示) 。
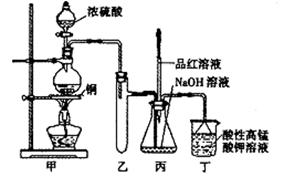
 实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:
实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 22.7g | 18.6g |
实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如下图所示:
请回答:
(1)实验中取一定量Cu片和一定量浓H2SO4放在圆底烧瓶中共热,至反应结束后,发现烧瓶中还有少量Cu剩余,有人认为还有一定量的H2SO4剩余,原因是
,在不增加浓H2SO4的前提下,若使剩余铜片溶解可再加入 (填写两种属于不同类别的物质)。
(2)向反应后的溶液中加入足量的CuO,使剩余的H2SO4全部转化为CuSO4,过滤后将滤液加热浓缩,冷却结晶制得硫酸铜晶体(CuSO4·XH2O)某小组同学采用加热法测定该晶体里结晶水X的值;
①在他们的实验操作中至少称量 次。
②下面是其中一次实验的数据
| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 22.7g | 18.6g |
根据上表数据计算判断x的实测值比理论值(x=5) (填“偏大”或“偏小”)。
(3)装置乙的作用是: ;
(4)下列说法正确的是: (填序号)。
a.甲装置使用的玻璃仪器有:酒精灯、玻璃管、长颈漏斗、圆底烧瓶
b.KMnO4溶液用于尾气处理
c.当把品红溶液滴入到锥形瓶中,若品红不褪色,说明无NaHSO3产生
d.当把品红溶液滴入到锥形瓶中,若品红褪色,说明NaOH已完全转化为NaHSO3
e.若把品红溶液换成酸性高锰酸钾溶液,并滴入到锥形瓶中,不显紫红色,说明NaOH已完全转化为NaHSO3
f.此装置换上其它药品后,不能制取和收集少量纯净的氯气
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com