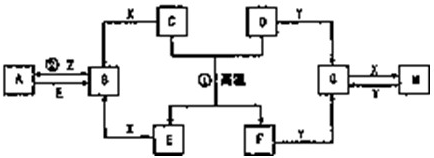
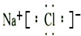右图表示各物质之间的转化关系.已知化合物A与B的组成元素相同,在常温下均呈液态;丙与丁的组成元素也相同,其相对分子质量均相差16n,n≥1.D与F是常见的固体单质,且块状的D、F与甲的浓溶液在常温作用都无明显现象,加热时有大量气体产生.乙中所含的某种元素是治疗贫血药物的主要成分,G可以作耐高温材料.(相关转化部分反应条件和生成物未标出).请回答下列问题:
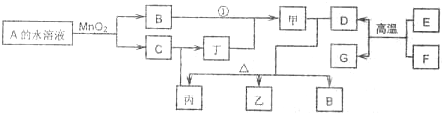
(1)A的结构式为
H-O-O-H
H-O-O-H
,在工业生产中E到D的反应用途是
焊接铁轨或冶炼金属
焊接铁轨或冶炼金属
(写一种).
(2)若反应①除生成甲外,还生成丙,写出过量D与甲的稀溶液反应时的离子方程式:
3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O
3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O
.
(3)以D、F为电极.NaOH溶液为电解质溶液可以组成原电池.该原电池负极的电极反应式为
Al-3e-+4OH-=4AlO2-+2H2O
Al-3e-+4OH-=4AlO2-+2H2O
.现利用此装置电解CuSO
4溶液(用惰性电极),电解一段时间后,阴阳两极产生的气体在标准状况下都是2.24L.请写出阳极的电极反应式:
4OH--4e-=O2↑+2H2O
4OH--4e-=O2↑+2H2O
;若电解前CuSO
4溶液的体积为200mL,则其物质的量浓度是
0.5mol/L
0.5mol/L
.
(4)若A与丙可以化合生成甲;甲的稀溶液和浓溶液分别与D在一定条件下反应可以生成组成组成元素完全不同的两种气体和其他物质.请写出A与丙化合生成甲的化学反应方程式:
H2O2+SO2=H2SO4
H2O2+SO2=H2SO4
.含有D元素的一种新型无机高分子材料高效净水剂[AlD(OH)
4Cl
2]
m与过量浓盐酸可以反应,其反应的化学方程式为
[AlFe(OH)4Cl2]m+4mHCl=mAlCl3+mFeCl3+4mH2O
[AlFe(OH)4Cl2]m+4mHCl=mAlCl3+mFeCl3+4mH2O
.