
题目列表(包括答案和解析)
(15分) Ⅰ、某同学用下图所示装置(尾气吸收装置未画出)向溶液Y中通入NH3和CO2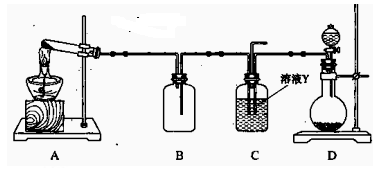
(1)下列为实验室制备NH3和CO2的备选药品:
a.NH4Cl b.CaCO3(块状) c.Ca(OH)2 d.NaOH e.浓氨水
f.稀盐酸 g.稀硫酸
则上述装置A处的试管中所放药品的最佳选择为 (用药品序号填
空,下同);装置D处固体药品的最佳选择为 (用药品序号填空)。
(2)下列各项制备实验中,也可利用装置D处仪器完成的是 (填序号)。
| A.MnO2与浓盐酸反应制备Cl2 | B.Cu与浓硫酸反应生成SO2 |
| C.由H2O2分解制O2 | D.乙醇与乙酸反应制备乙酸乙酯 |
(15分) Ⅰ、某同学用下图所示装置(尾气吸收装置未画出)向溶液Y中通入NH3和CO2
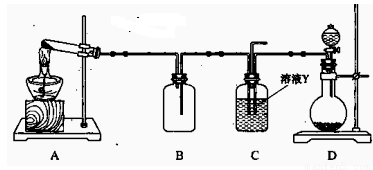
(1)下列为实验室制备NH3和CO2的备选药品:
a.NH4Cl b.CaCO3(块状) c.Ca(OH)2 d.NaOH e.浓氨水
f.稀盐酸 g.稀硫酸
则上述装置A处的试管中所放药品的最佳选择为 (用药品序号填
空,下同);装置D处固体药品的最佳选择为 (用药品序号填空)。
(2)下列各项制备实验中,也可利用装置D处仪器完成的是 (填序号)。
A.MnO2与浓盐酸反应制备Cl2 B.Cu与浓硫酸反应生成SO2
C.由H2O2分解制O2 D.乙醇与乙酸反应制备乙酸乙酯
E.Zn与稀硫酸反应制备H2
(3)写出上述装置A处的试管中所发生反应的化学方程式:
。
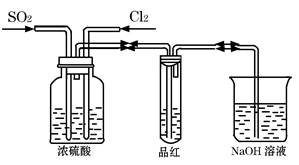
Ⅱ、甲同学利用下图所示装置探究SO2和Cl2两种气体按不同比例混合后的漂白性。
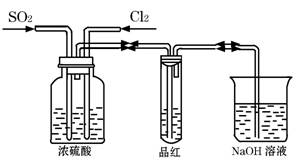
试分析:
①在气体进入品红溶液之前,先将SO2和Cl2通过盛有浓硫酸装置的目的是:
。
②甲同学在实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其原因是: (结合反应方程式)。

| A.MnO2与浓盐酸反应制备Cl2 | B.Cu与浓硫酸反应生成SO2 |
| C.由H2O2分解制O2 | D.乙醇与乙酸反应制备乙酸乙酯 |

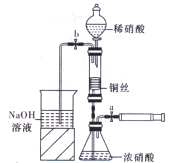 某同学用下面装置实现铜与浓、稀硝酸反应,过程如下:
某同学用下面装置实现铜与浓、稀硝酸反应,过程如下: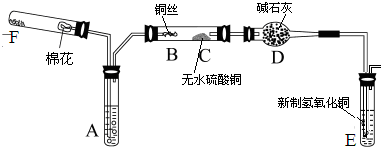
| 催化剂 |
| 催化剂 |
| Cu |
| 加热 |
| Cu |
| 加热 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com