
题目列表(包括答案和解析)
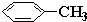
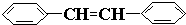
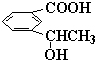

原子序数依次增大的A、B、C、D、E、F(A、B、C、D、E、F分别代表元素符号)六种短周期元素。元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,D+比F-少一个电子层,E所在周期的各元素单质沸点变化如下图(元素按原子序数递增顺序连续排列),B、C两种元素分别能与A形成等电子的甲、乙两种分子,且两种分子中各原子的个数见下表:
化合物 | 甲 | 乙 |
原子个数比 | B∶A=1∶4 | C∶A=1∶3 |
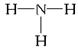
(1)元素E的基态原子的电子排布式为________________________。
(2)写出化合物乙的结构式__________________,该分子中C的原子轨道发生的是____________杂化。
(3)B、C形成的一种化合物X是一种原子晶体,晶体中B、C原子均达到8电子稳定结构,则X的化学式为__________________。
(4)D在F中燃烧的产物属于______________晶体,其晶体中与D+最近且等距离的F-有___________个。
[选修物质结构与性质](15分)
A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增。已知:B原子核外最外层电子数是次外层电子数的两倍,电子总数是E原子总数的1/2,F是同周期元素中原子半径最小的元素;D2-与E2+的电子层结构相同。B与D可以形成三原子化合物甲。A是非金属元素,且A、C、F可形成离子化合物乙。请回答:
(1)C单质的电子式 ,F元素原子的电子排布式 ,E元素的原子结构示意图是 。
(2)化合物乙中含有的化学键是 。
(3)化合物甲为固体时属于 晶体,E单质在一定条件下与甲反应的化学方程式为 。
(4)如图立方体中心的“·”表示B单质所形成的原子晶体中的一个原子,请在立方体的顶点用“·”表示出与之紧邻的B原子
[选修物质结构与性质](15分)
A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增。已知:B原子核外最外层电子数是次外层电子数的两倍,电子总数是E原子总数的1/2,F是同周期元素中原子半径最小的元素;D2-与E2+的电子层结构相同。B与D可以形成三原子化合物甲。A是非金属元素,且A、C、F可形成离子化合物乙。请回答:
(1)C单质的电子式 ,F元素原子的电子排布式 ,E元素的原子结构示意图是 。
(2)化合物乙中含有的化学键是 。
(3)化合物甲为固体时属于 晶体,E单质在一定条件下与甲反应的化学方程式为  。
。
(4)如图立方体中心的“·”表示B单质所形成的原子晶体中的一个原子,请在立方体的顶点用“·”表示出与之紧邻的B原子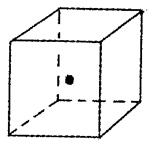
[选修物质结构与性质](15分)
A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增。已知:B原子核外最外层电子数是次外层电子数的两倍,电子总数是E原子总数的1/2,F是同周期元素中原子半径最小的元素;D2-与E2+的电子层结构相同。B与D可以形成三原子化合物甲。A是非金属元素,且A、C、F可形成离子化合物乙。请回答:
(1)C单质的电子式 ,F元素原子的电子排布式 ,E元素的原子结构示意图是 。
(2)化合物乙中含有的化学键是 。
(3)化合物甲为固体时属于 晶体,E单质在一定条件下与甲反应的化学方程式为 。
(4)如图立方体中心的“·”表示B单质所形成的原子晶体中的一个原子,请在立方体的顶点用“·”表示出与之紧邻的B原子

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com