
题目列表(包括答案和解析)
(8分)氯气及氯的化合物有着广泛的应用
(1)已知可逆反应Cl2+H2O HCl+HClO,向氯水中加入NaHCO3固体后,溶液中HClO的浓度 (填增大、减小、不变),原因是: 。
HCl+HClO,向氯水中加入NaHCO3固体后,溶液中HClO的浓度 (填增大、减小、不变),原因是: 。
(2)我国卫生部已明确提出:逐步用二氧化氯替代氯气进行饮用水的消毒。
①用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-)。卫生部规定,饮用水中ClO 2-的含量应不超过0.2mg·L-1。当pH≤2.0时, ClO2-能被I-还原成Cl-。请写出反应的离子方程式 。
2-的含量应不超过0.2mg·L-1。当pH≤2.0时, ClO2-能被I-还原成Cl-。请写出反应的离子方程式 。
②用ClO2处理过的自来水中会残留ClO2 ,可用FeCl2将ClO2还原为Cl-,该反应的氧化产物是 (填化学式)。现用V L(已换算为标准状况)ClO2处理一定量自来水,再加入a mol FeCl2可将残留的ClO2恰好除去。则该自来水中残留ClO2的物质的量为 mol。
氯气及氯的化合物有着广泛的应用![]()
(1)已知可逆反应Cl2+H2O ![]() HCl+HClO,向氯水中加入NaHCO3固体后,溶液中HClO的浓度 (填增大、减小、不变),原因是: 。
HCl+HClO,向氯水中加入NaHCO3固体后,溶液中HClO的浓度 (填增大、减小、不变),原因是: 。
(2)我国卫生部已明确提出:逐步用二氧化氯替代氯气进行饮用水的消毒。
①用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-)。卫生部规定,饮用水中ClO2-的含量应不超过0.2mg·L-1 。当pH≤2.0时, ClO2-能被I-还原成Cl-。请写出反应的离子方程式 。
②用ClO2处理过的自来水中会残留ClO2 ,可用FeCl2将ClO2还原为Cl-,该反应的氧化产物是 (填化学式)。现用V L(已换算为标准状况)ClO2处理一定量自来水,再加入a mol FeCl2可将残留的ClO2恰好除去。则该自来水中残留ClO2的物质的量为 mol。

 HCl+HClO,向氯水中加入NaHCO3固体后,溶液中HClO的浓度 (填增大、减小、不变),原因是: 。
HCl+HClO,向氯水中加入NaHCO3固体后,溶液中HClO的浓度 (填增大、减小、不变),原因是: 。 2-的含量应不超过0.2mg·L-1。当pH≤2.0时, ClO2-能被I-还原成Cl-。请写出反应的离子方程式 。
2-的含量应不超过0.2mg·L-1。当pH≤2.0时, ClO2-能被I-还原成Cl-。请写出反应的离子方程式 。 Cu2O + H2↑。阳极反应式为_________;Cu2O投入稀硫酸中,得到蓝色溶液和红色沉淀,写出该反应的离子方程式___________________。
Cu2O + H2↑。阳极反应式为_________;Cu2O投入稀硫酸中,得到蓝色溶液和红色沉淀,写出该反应的离子方程式___________________。 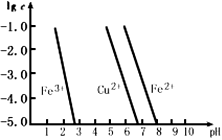
钢铁等铁制品是应用最广泛的金属材料,铁元素的单质及其化合物在元素化合物世界始终扮演着重要角色。
I.打磨过的细铁丝可在纯氧中剧烈燃烧,最终生成黑色固体,其化学式为 ;铁粉与水蒸气在高温下也可生成该黑色固体,反应的化学方程式为 。
II.某校探究性学习小组用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜。探究过程如下:

请回答下列问题:
(1)步骤②中,除发生反应Fe +2HCl=FeCl2+H2↑外,其他可能反应的离子方程式为 。
(2)若溶液B中只含有Fe2+而不含Fe3+,可证明该事实的实验方法是( )
①先加氯水,后加KSCN溶液后显红色;
②先加KSCN溶液,不显红色,再加氯水后显红色;
③滴加NaOH溶液,只产生白色沉淀,迅速变为灰绿色,最后呈红褐色;
④只滴加KSCN溶液不显红色。
A.①② B.②⑨ C.⑨④ D.①④
(3)步骤⑤产生金属铜的化学方程式为 。
Ⅲ.金属的腐蚀所导致的钢铁损耗占钢铁年产量的l/4还多。在钢铁的吸氧腐蚀过程中,正极反应式为 ,若此过程中共生成了8 gFe2O3,则转移的电子的物质的量为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com